Урок "Розв’язування розрахункових задач: обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини, масі, об’ємі."
Тема: Розв’язування розрахункових задач: обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини, масі, об’ємі.
Мета: ― систематизувати знання про кількість речовини, молярну масу, молярний об’єм;
― продовжити формувати вміння виконувати обчислення кількості речовини, молярної маси, маси речовини, об’єму та відносної густини газів;
― підготувати учнів до тематичного оцінювання з теми «Кількість речовини. Розрахунки за хімічними формулами»;
― розвивати хімічну мову;
― виховувати відповідальне ставлення до виконання завдань.
Тип уроку: застосування набутих знань і умінь.
Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер, періодична система хімічних елементів Д.І. Менделєєва.
Форми роботи: індивідуальна, в парах, фронтальна, самостійна.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
- Картка «Самоаналіз знань з теми»
|
№ |
Запитання |
Так |
Ні |
Примітка |
|
1. |
Чи вмію робити скорочений запис? |
|
|
|
|
2. |
Чи вмію обчислювати молярні маси? |
|
|
|
|
3. |
Чи швидко згадую потрібну формулу? |
|
|
|
|
4. |
Чи знаю послідовність виконання дій, необхідних для розв’язування? |
|
|
|
|
5. |
Чи вмію записувати відповіді? |
|
|
|
- Формульний диктант
n = ![]() ; m = n • M; M =
; m = n • M; M = ![]()
n = ![]() ; N = n •
; N = n •![]() ; Na =
; Na = ![]()
n = ![]() ; V = n • Vm ; Vm =
; V = n • Vm ; Vm = ![]()
Dгазу = 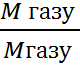
- Установіть відповідність між позначеннями та одиницями вимірювання
|
Позначення |
Одиниці вимірювання |
|
а) 6,02*1023 |
|
б) моль |
|
в) г, кг |
|
г) г/моль |
|
д) 22,4 л/моль |
|
е) л |
|
ж) частинок |
- – в; 2. – е; 3. – г; 4. – б; 5. – ж; 6. – д; 7. - а.
ІІІ. Мотивація навчальної діяльності
Кожен розуміє, що точна наука без задач – як пташка без крил.
На цьому уроці, ми узагальнимо та вдосконалимо набуті знання й уміння по розв’язуванню розрахункових задач з теми кількість речовини.
IV. Застосування набутих знань
- Демонстраційне розв’язування задачі на дошці.
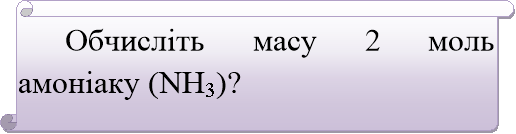
Відповідь: m = 2 моль * 17 г/моль = 34 г
- «Заморочки з бочки»



- Розв’язування задач
|
|
H2O |
NaCl |
CO2 |
|
m, г |
36 |
|
|
|
M, г/моль |
|
|
|
|
n, моль |
|
|
|
|
N, частинок |
|
12,04*1023 |
|
|
V, л |
|
|
11,2 |
Відповіді:
|
|
H2O |
NaCl |
CO2 |
|
m, г |
36 |
117 |
22 |
|
M, г/моль |
18 |
58,5 |
44 |
|
n, моль |
2 |
2 |
0,5 |
|
N, частинок |
12,04*1023 |
12,04*1023 |
3,01*1023 |
|
V, л |
44,8 |
44,8 |
11,2 |
- Обчислення відносної густини газу за іншим газом
|
|
Кисень |
Хлор |
Нітроген (ІІ) оксид |
|
За вуглекислим газом |
0,73 |
1.6 |
0,68 |
|
За повітрям |
1,1 |
2,45 |
1,03 |
V. Самостійна робота
Кожен учень обирає посильні йому завдання з конверта відповідного кольору.
І-ІІ рівень (до 6 балів) – зелений
Варіант І
- Обчислити об’єм кисню (н.у.) кількістю речовини 3 моль.
- Обчислити відносну густину метану (CH4) за воднем.
Варіант ІІ
- Обчислити кількість речовини літій оксиду масою 3 г.
- Обчислити відносну густину етану (C2H6) за гелієм.
ІІІ рівень (до 9 балів) – жовтий
Варіант І
- Обчислити масу метану (CH4) об’ємом 2,24 л за н.у..
- Обчислити відносну густину карбон (ІІ) оксидуза повітрям.
Варіант ІІ
- Обчислити об’єм гідроген сульфіду (H2S) (н.у.) масою 3,4 г.
- Обчислити відносну густину нітроген (І) оксиду за повітрям.
ІV рівень (до 12 балів) – червоний
Варіант І
- Обчислити кількість атомів Оксигену в нітоген (ІV) оксиді масою 9,2 г.
- Обчислити відносну густину газу повітрям, якщо його відносна густина за вуглекислим газом становить 1,045.
Варіант ІІ
- Обчислити масу хлору, якщо кількість атомів становить 1,204*1023.
- Обчислити відносну густину газу за киснем, якщо його відносна густина за повітрям становить 1,241.
VІ. Підведення підсумків
Повернемось до картки «Самоаналіз знань з теми» чи змінилась кількість ваших результатів.
VІІ. Домашнє завдання
Повторити формули, диференційовані завдання на картках.





про публікацію авторської розробки
Додати розробку
