Урок у 8 класі "Будова атома".
Тема. Будова атома. Склад атомних ядер. Протонне й нуклонне число.
Мета: вивчити будову атома, склад атомних ядер; протонне та нуклонне числа, розвивати вміння розраховувати число протонів і нейтронів у ядрах атомів, знаходити у ПС протонне і нуклонне числа для кожного елемента, записувати формули нуклідів, ізотопів, знати їх значення; виховувати вміння працювати самостійно.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
Письмова перевірка домашнього завдання за картками.
ІІІ. Мотивація навчальної діяльності
Сьогодні ми дізнаємось, чим один атом в ПСХЕ відрізняється від іншого атома, а саме вивчимо будову атома, склад атомних ядер.
ІV. Оголошення теми і мети уроку
V. Вивчення нового матеріалу
1. Уявлення про будову атома.
1.1. Уявлення Демокрита.
1.2. Модель будови атома Томсона.
1.3. Сучасні уявлення про будову атома. Планетарна модель будови атома Резерфорда.
Д.І.Менделєєв відкрив періодичний закон, створив ПСХЕ, але не пояснив причину періодичності, подібності і відмінності властивостей елементів. Пояснила ці закономірності лише створена в XX столітті теорія будови атома.
За сучасною теорією атом – це електронейтральна система, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки.
Число позитивних зарядів ядра кожного атома і число електронів, які обертаються навколо ядра, дорівнює порядковому номеру елемента.
Таку модель атома запропонував в 1911р Е.Резерфорд, має назву ядерна модель будови атома.
Атом
![]()
![]()
![]()
ядро ( + ) електрони( - )
![]() е ( m = 0 )
е ( m = 0 )
протони нейтрони ( z = -1 )
р ( m = 1 ) n ( m = 1 )
( z = + 1 ) ( z = 0 )
---------------------------------
нуклони
Ядро – це центральна позитивно заряджена частина атома, в якій зосереджена його маса. В ядрі містяться елементарні частинки – протони та нейтрони.
Протон – це частинка з масою 1 а.о.м. і позитивним зарядом. Верхній індекс маса, нижній заряд – це кількісні характеристики протона.
Нейтрон – це електронейтральна частинка з масою 1аом. і зарядом 0.
Електрон – це частинка з масою – 0 і зарядом -1.
Протони і нейтрони разом розглядаються як два різних стани ядерної частинки нуклона.
Дізнатись про кількість протонів, нейтронів, нуклонів і електронів в атомі можливо за допомогою ПСХЕ: - кількість р = № елемента і називається протонним числом, протонне число позначається зліва внизу (нижній індекс);
- кількість n + р = Ar, і називається нуклонним числом (верхній індекс).
![]()
![]() Нуклонне число 23 Відносна атомна маса (Аr)
Нуклонне число 23 Відносна атомна маса (Аr)
Na
![]()
![]() Протонне число 11 Порядковий номер (Z )
Протонне число 11 Порядковий номер (Z )
- За допомогою ПС визначити склад атомних ядер таких хімічних елементів:
K, Al, Mg, Zn, Fe, N, C.
Зобразити і визначити кількість протонів, нейтронів.
- Елемент має 10 нейтронів і відносну атомну масу 19. Визначити, що це за хімічний елемент.
- Елемент стоїть у ІІІ групі. Відносна молекулярна маса його вищого оксиду дорівнює 102. Визначте який це елемент. Розрахуйте кількість протонів і нейтронів у ядрі його атома.
VI. Закріплення вивченого
- Заповни таблицю:
|
Назва елемента |
Символ елемента |
Порядковий номер |
Аr |
Заряд ядра |
Нуклонне число А |
р |
е |
n |
|
|
Mg |
|
|
|
|
|
|
|
|
Алюміній |
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
39 |
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
18 |
|
|
- За наведеними моделями атомів визнач хімічні елементи, яким вони належать та кількість елементарних частинок:
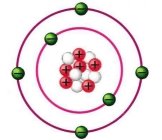
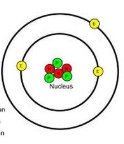
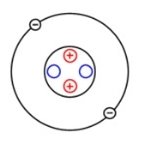
- Визнач хімічний елемент:
- Протонне число атома хімічного елемента становить 17 (хлор),
- Нуклонне число дорівнює 9, кількість електронів 4 (берилій),
- Атом цього елемента має н 5 електронів менше, ніж атом Магнію (нітроген),
- Нуклонне число дорівнює 40, кількість протонів 20 (кальцій),
- Кількість протонів становить 11, нейтронів 12, електронів 11 (натрій).
- Підведення підсумків уроку.
Сьогодні на уроці я дізнався нового…
Сьогодні на уроці я був здивований…
Сьогодні на уроці була відома мені інформація про …
Сьогодні на уроці мені не сподобалося …
- Домашнє завдання.
§9-вч., завд.1-10-усно, завд.29-30-письмово, завд.31-32-додатково за бажанням
-
Дякую


про публікацію авторської розробки
Додати розробку
