Урок в 9 класі "Молекулярні й структурні формули. Назви, фізичні властивості гомологів метану".
Мета: - повторити особливості будови атома Карбону, метану як представника органічних сполук, закріпити знання про просторову будову молекул вуглеводнів, вивчити поняття гомології, сформувати уявлення про гомологічні ряди на прикладі алканів, знання про просторову будову молекул алканів, уміння учнів складати структурні формули насичених вуглеводнів; розкрити значення методу моделювання, ознайомити з фізичними властивостями гомологів метану;
-розвивати навички і вміння у виготовленні кулестержневих моделей молекул алканів, аналізувати, встановлювати причинно-наслідкові зв'язки між складом, будовою, властивостями речовин на прикладі алканів, робити узагальнюючі висновки;
-виховувати інтерес до предмету, відповідальність, впевненість у собі, вміння працювати в команді, сприяти формуванню соціальних, творчих компетентностей учнів, вихованню художньо-естетичного смаку.
Тема. Молекулярні й структурні формули. Назви, фізичні властивості гомологів метану
Мета: - повторити особливості будови атома Карбону, метану як представника органічних сполук, закріпити знання про просторову будову молекул вуглеводнів, вивчити поняття гомології, сформувати уявлення про гомологічні ряди на прикладі алканів, знання про просторову будову молекул алканів, уміння учнів складати структурні формули насичених вуглеводнів; розкрити значення методу моделювання, ознайомити з фізичними властивостями гомологів метану;
- розвивати навички і вміння у виготовленні кулестержневих моделей молекул алканів, аналізувати, встановлювати причинно-наслідкові зв’язки між складом, будовою, властивостями речовин на прикладі алканів, робити узагальнюючі висновки;
- виховувати інтерес до предмету, відповідальність, впевненість у собі, вміння працювати в команді, сприяти формуванню соціальних, творчих компетентностей учнів, вихованню художньо-естетичного смаку.
Тип уроку: урок засвоєння нових знань
Обладнання: картки - ігрові поля для лото, фішки, тетраедр, саморобні моделі молекули метану, набір деталей для виготовлення кулестержневих моделей, учнівський проект «Конструктивізм. Моделювання в хімії», таблиці «Насичені вуглеводні», програмно-методичний комплекс «Органічна хімія, 10-11 клас», опорний конспект, картки самооцінювання.
Хід уроку
- Організація класу
Учитель. Доброго дня! Сьогодні на нас чекає урок… Він неможливий без учнів і вчителя. Давайте дізнаємось про наші очікування від уроку.
Вправа «НАДІЯ» - спеціальна психологічна вправа, яка створює атмосферу довіри, об’єднує учасників навчального процесу.
На дошці вивішується три плакати у формі прямокутників:
![]()
![]()
![]()
За початковими літерами учні і учитель висловлюють свої надії, очікування.
Яким ви хочете бачити учителя?
У – урівноваженим, усміхненим, успішним …
Ч – чарівним, чудовим, чесним …
И (І) – інтелігентним …
Т – творчим, тактовним …
Е – ерудованим …
Л – люб’язним, лояльним, лагідним …
Учитель хоче бачити учнів:
У – уважними …
Ч – чемними, чесними …
Н – наполегливими …
І – ініціативними …
Який урок ви чекаєте?
У –…
Р – розвиваючий, радісний …
О – особливий …
К – кольоровий …
Об’єднання учнів в групи. Учні розраховуються на 1,2,3,4-ий. За номерами об’єднуються в групи.
Пояснення про роботу з карткою самооцінювання
|
Прізвище, ім’я учня |
Хімічне лото |
Усні відповіді |
Всього балів |
|
|
|
|
|
- Актуалізація опорних знань
Хімічне лото
Кожній групі видаємо картку – ігрове поле (додаток 1), на якому в клітинках написані терміни, формули, і фішки трьох кольорів: синього, жовтого, червоного для заповнення ігрового поля. На кожній фішці написано число, яке вказує на номер запитання. Учитель називає номер запитання, озвучує його, а учень фішкою з відповідним номером закриває відповідь на нього. Група, накривши один ряд фішками, піднімає руку, у разі правильного виконання отримує бонусний бал (слайд № ), другий ряд – ще один бал (слайд № ). У разі знаходження помилок бал знімаємо.
Якщо вся картка заповнена правильно – група отримує 6 балів, 2 ряди – 4 бали, 1 ряд – 2 бали.
Запитання до гри
- Елемент, який становить основу органічних сполук.
- Наука, яка вивчає сполуки Карбону.
- Вкажіть основний компонент природного газу.
- Вкажіть валентність Карбону в органічних сполуках.
- Вкажіть тип гібридизації орбіталей атома Карбону в молекулі метану.
- Зазначте електронну формулу атома Карбону в нормальному стані.
- Які атоми входять до складу молекули метану?
- Вкажіть основну галузь застосування метану.
- Молекулярна формула метану.
- Зазначте електронну формулу атома Карбону у збудженому стані.
- Вкажіть просторову будову молекули метану.
- Які зв’язки утворюються між атомами в молекулі метану?
- Мотивація навчання, повідомлення теми
Всяка речовина – від самої простої до самої складної, має три різні, але взаємозв’язані сторони – властивість, склад, будова.
Б.М. Кедров
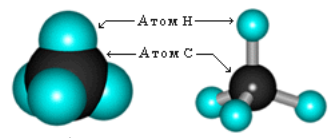
Учитель демонструє учням кулестержневу та масштабну моделі молекули метану.
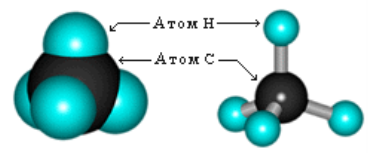
Учитель ставить запитання учням:
- Модель якої молекули ви бачите? (модель молекули метану).
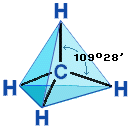
- Яка її просторова будова? (тетраедрична будова). Звертаємо увагу на тетраедр.
- Асоціації з чим у вас виникають?
- З яких матеріалів можна виготовити подібні моделі молекул речовин? (пластилін, папір, пап’є-маше, поролон, бісер, тісто тощо).
- З якою метою виготовляють моделі молекул? (Моделі молекул допомагають уявити реальні об’єкти).
Учитель. Сьогодні на уроці ви будете конструювати моделі молекул органічних сполук, схожих за складом, будовою, властивостями з метаном.
Повідомлення теми уроку й завдань.
- Що таке конструктивізм? Моделювання?
- З якою метою проводять моделювання в хімії?
Я пропоную реалізувати ваші уявлення в проекті «Конструктивізм. Моделювання в хімії», як, наприклад, це зробив учень 9 класу.
Демонстрація частини проекту «Конструктивізм. Моделювання в хімії» (додаток 2).
- Вивчення нової теми
Зберемо модель молекули метану (робота в групах).
Звертаємо увагу учнів на колір атомів Карбону і Гідрогену.
Ми уже знаємо, що атоми Карбону в органічних сполуках мають здатність сполучатись між собою, утворюючи ланцюги.
Спробуємо сполучити два атоми Карбону між собою. При цьому вони надають у спільне користування по одному електрону, утворюючи ковалентний зв'язок. У кожного з атомів залишається по три електрони, що можуть утворити спільні електронні пари з трьома атомами Гідрогену. Зобразимо електронну формулу даної сполуки:
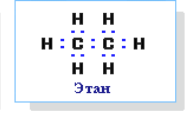
З’єднаємо послідовно три атоми Карбону, пам’ятаючи, що він чотирьохвалентний:
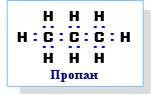
Аналогічно зображуємо формули бутану і пентану.
До складу наведених сполук входять лише атоми Карбону і Гідрогену, що повністю використали свої валентності – всі валентності атома Карбону насичені атомами Гідрогену. Такі сполуки називаються насиченими вуглеводнями. За історичною номенклатурою – парафінами («малодіяльні»). За міжнародною – алканами.
Робота в групах з наступним колективним обговоренням
- Проаналізуйте записані формули. Що в них спільного і чим вони відрізняються?
- Позначивши число атомів Карбону в молекулі n, виведіть загальну формулу алканів.
Висновки:
Формули відрізняються групою СН2. Ця група називається гомологічною різницею. Речовини, що подібні за будовою і властивостями, але відрізняються на групу СН2, утворюють гомологічні ряди. Речовини, що входять в один гомологічний ряд, називаються гомологами.
Всі зв’язки, насичені Гідрогеном, і є одинарними. Суфікс –ан вказує на те, що всі зв’язки одинарні.
Робота з таблицею «Насичені вуглеводні» (с. 135)
Розглянемо таблицю гомологічного ряду алканів. Родоначальником цього гомологічного ряду є метан, іноді цей ряд так і називають – гомологічний ряд метану.
В основу назв покладено корінь, що вказує на кількість атомів Карбону в ланцюгу. Перші чотири назви склалися історично, а наступні походять від грецьких назв числівників.
Структурні формули, що записані в таблиці, не відображають істинного розташування атомів в просторі. Щоб уявити собі дані молекули, виконаємо лабораторний дослід.
Фізичні властивості алканів
Перегляд відеофрагменту програмно-методичного комплесу «Органічна хімія, 10-11 клас» (фізичні властивості алканів).
Передивляючись, учні заповнюють таблицю:
|
Властивість |
Насичені вуглеводні |
|
Агрегатний стан |
С1-С4 – С5-С17 - С18 - |
|
Запах |
С1-С4 – С5-С17 - С18 - |
|
Розчинність у воді |
|
|
Розчинність в органічних розчинниках |
|
|
Температура плавління |
|
|
Температура кипіння |
|
Учитель.
- Проаналізуйте дані таблиці «Насичені вуглеводні» та зробіть висновок про взаємозв’язок між кількістю атомів Карбону в молекулі і температурами кипіння і плавління.
Висновок. Із збільшенням числа атомів в ланцюзі, тобто з ростом відносної молекулярної маси, зростає температура кипіння і плавлення алканів. Вони практично нерозчинні у воді, оскільки їхні молекули малополярні й не взаємодіють з молекулами води, але вони добре розчиняються в органічних неполярних розчинниках. Рідкі алкани легко змішуються один з одним (бензин).
- Первинне засвоєння знань (робота в групах)
Виконання лабораторного досліду.
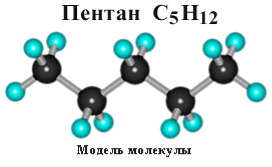 Тема. Виготовлення молекул моделей вуглеводнів
Тема. Виготовлення молекул моделей вуглеводнів
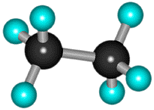
 Зберемо модель молекули етану, пам’ятаючи про тетраедричну напрямленість хімічних зв’язків (кут 109, 5О) -робота в групах. Збираємо моделі пропану, бутану, пентану. Звертаємо увагу учнів на тетраедричну напрямленість зв’язків, можливість вільного обертання атомів навколо карбон-карбонових зв’язків.
Зберемо модель молекули етану, пам’ятаючи про тетраедричну напрямленість хімічних зв’язків (кут 109, 5О) -робота в групах. Збираємо моделі пропану, бутану, пентану. Звертаємо увагу учнів на тетраедричну напрямленість зв’язків, можливість вільного обертання атомів навколо карбон-карбонових зв’язків.
- Підсумки
 Заповніть схему, розставивши її частини у логічній послідовності.
Заповніть схему, розставивши її частини у логічній послідовності.


![]()
![]()




Виставлення оцінок за урок
Підрахуйте кількість балів, набраних вами за урок. Якщо ви задоволені результатом, намалюйте сонечко, якщо ні – хмаринку (оцінка в журнал виставлятись не буде).
Рефлексія
- Що нового дізналися на уроці?
- Який матеріал був важким?
- Про що хотів би дізнатись більше?
Учитель. Сьогодні на уроці мені приємно було з вами працювати. Ви були уважними, чемними, наполегливими, ініціативними. І даний смайлик відображає мій настрій – саме ви його створили. У вас на партах також є смайлики. Якщо ваш настрій співпадає з усміхненим обличчям, залиште його на дошці на плакаті зі словом урок.
-
 Домашнє завдання
Домашнє завдання
![]() § 21 – вчити, завд. 1-3, 5-8-усно, - середній - достатній рівень - високий
§ 21 – вчити, завд. 1-3, 5-8-усно, - середній - достатній рівень - високий
4-письмово
Завд.14,15 – письмово Творча робота
Додаток 1
Картка-ігрове поле для лото
|
Органічна
|
Тетраедрична |
Ковалентні |
1s12s22p2 |
|
IV |
1s22s12p3 |
Карбон і Гідроген
|
СН4 |
|
Карбон |
sp3 |
Метан
|
Паливо |
Додаток 2
Проект «Конструктивізм. Моделювання в хімії»






Додаток 3
Опорний конспект
«Всяка речовина – від самої простої до самої складної, має три різні, але взаємозв’язані сторони – властивість, склад, будова».
Б.М.Кедров
Тема. Молекулярні й структурні формули. Назви, фізичні властивості гомологів метану.
Запитання до гри «Хімічне лото»
- Елемент, який становить основу органічних сполук.
- Наука, яка вивчає сполуки Карбону.
- Вкажіть основний компонент природного газу.
- Вкажіть валентність Карбону в органічних сполуках.
- Вкажіть тип гібридизації орбіталей атома Карбону в молекулі метану.
- Зазначте електронну формулу атома Карбону в нормальному стані.
- Які атоми входять до складу молекули метану?
- Вкажіть основну галузь застосування метану?
- Молекулярна формула метану.
- Зазначте електронну формулу атома Карбону у збудженому стані.
- Вкажіть просторову будову молекули метану.
- Які зв’язки утворюються між атомами в молекулі метану?
Моделі молекули метану


Розглянемо й запишемо формули наступних речовин.
|
К-сть Карбону |
Електронна формула |
Структурна формула |
Молекулярна формула |
Назва |
|
2 атоми Карбону |
|
|
|
|
|
3 атоми Карбону |
|
|
|
|
|
4 атоми Карбону |
|
|
|
|
|
5 атомів Карбону |
|
|
|
|
До складу наведених сполук входять лише атоми Карбону і Гідрогену, що повністю використали свої валентності – всі валентності атома Карбону насичені атомами Гідрогену. Такі сполуки називаються насиченими вуглеводнями. За історичною номенклатурою – парафінами («малодіяльні»). За міжнародною – алканами.
Подумай і дай відповідь
- Проаналізуйте записані формули. Що в них спільного? _____________________________________________________.
- Чим вони відрізняються? ________________________________.
- Позначивши число атомів Карбону в молекулі n, виведіть загальну формулу алканів ___________________.
Група атомів СН2називається гомологічною різницею. Речовини, що подібні за будовою і властивостями, але відрізняються на групу СН2, утворюють гомологічні ряди. Речовини, що входять в один гомологічний ряд, називаються гомологами.
Всі зв’язки, насичені Гідрогеном, є одинарними. Суфікс –ан вказує на те, що всі зв’язки одинарні.
Заповніть таблицю:
Фізичні властивості алканів
|
Властивість |
Насичені вуглеводні |
|
Агрегатний стан |
С1-С4 – С5-С17 - С18 - |
|
Запах |
С1-С4 – С5-С17 - С18 - |
|
Розчинність у воді |
|
|
Розчинність в органічних розчинниках |
|
|
Температура плавління |
|
|
Температура кипіння |
|
Лабораторний дослід № 6
Тема. Виготовлення моделей молекул вуглеводнів
Мета: закріпити знання про просторову будову молекул вуглеводнів на прикладі етану, пропану, бутану, пентану.
Обладнання: набір деталей для виготовлення кулестержневих моделей молекул.
Рекомендації щодо роботи: кульки, що імітують атом Карбону, – чорного кольору, атом Гідрогену – білого.
Техніка безпеки:
- Усі дії в кабінеті хімії виконуй спокійно.
- Працюй, не піднімаючись з робочого місця.
Хід роботи
Моделювання – це вивчення явищ або об’єкта за допомогою його аналогів (моделей).
Для виготовлення моделей гомологів метану послідовно сполучай між собою кульки чорного кольору (Карбону) та приєднуй кульки білого кольору (Гідрогену). Пильнуй, щоб атоми Карбону були чотирьохвалентні!
З’єднуючи атоми Карбону з дотриманням тетраедричного напрямку хімічних зв’язків, зверни увагу, що ланцюг може набувати різної форми (мал. 82, с. 136).
Зібравши модель, переконайся у можливості вільного обертання атомів навколо карбон-карбонових зв’язків, завдяки чому молекула може набувати інших форм.
Заповни таблицю:
|
Назва речовини |
Молекулярна формула |
Структура карбонового скелету |
Кількість зв’язків |
Тип гібридизації |
Валентний кут |
|
Метан |
|
|
|
|
|
|
Етан |
|
|
|
|
|
|
Пропан |
|
|
|
|
|
|
Бутан |
|
1) 2) |
|
|
|
|
Пентан |
|
1) 2) 3)
|
|
|
|
Висновок. Моделі відображають структуру мікрооб’єктів, принципи їхньої будови, однак, не відтворюють зовнішнього вигляду.
Взаємозв’язок складу і будови насичених вуглеводнів



![]()
![]()




про публікацію авторської розробки
Додати розробку
