Урок відкритого показового заняття "Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура.Фізичні та хімічні властивості спиртів. Застосування та дія на"
Слайд 1
Актуалізація опорних знань
На попередніх заняттях ми ознайомились з вуглеводнями, а саме, алканами, алкенами та алкінами . Вивчили їх будову, номенклатуру, фізичні та хімічні властивості. Тому нагадаємо:
Фронтальне опитування за технологією «Мікрофон»
- Типи формул, які використовуються в органічній хімії?
- Які речовини називають вуглеводнями?
- Залежно від хімічної будови і властивостей на які групи поділяють вуглеводні?
- Які хімічні зв`язки характерні для насичених і ненасичених вуглеводнів?
- Які сполуки називаються гомологами, а які ізомерами.
Слайд 2
- Як класифікують органічні сполуки?
Сьогодні ми розпочинаємо вивчати оксигеновмісні органічні сполуки
І тема нашого заняття -
Слайд 3
Метою нашого заняття - ознайомитись з представниками оксигеновмісних органічних сполук – спиртами;
- з'ясувати ізомерію та систематичну номенклатуру спиртів;
- показати зв’язок фізичних властивостей спиртів з наявністю функціональної гідроксильної групи;
- поглибити знання про фізичні та хімічні властивості спиртів.
- ознайомитись з дією спиртів на організм людини
Слайд 4
Проблемне питання: Сьогодні ми познайомимося з новим класом сполук. Розглянемо їх найяскравіших представників та спробуємо пояснити, яким чином будова молекули впливає на реакційну здатність та застосування в різних галузях промисловості.
Отже, план заняття Слайд 5
Мотивація навчальної діяльності.
Особлива актуальність теми спирти пов'язана з великим застосуванням у різних галузях: медицині, парфумерії, фармації, харчовій промисловості
Спирти є досить поширеними сполуками у природі і виконують в живих організмах різноманітні функції. Ще більш поширеними сполуками є похідні спиртів, серед яких перш за все слід відзначити складні ефіри , які обумовлюють запах рослин і входять до складу так званих ефірних масел. Деякі спирти входять до складу жирів, бджолиного воску, моторного палива …Тому, Ви, як майбутні маркетологи, будете мати справу з такою продукцією і щоб прорекламувати їх на ринку ви повинні знати склад, властивості та дію на організм людини та навколишнє середовище.
1.Оксигеновмісні органічні сполуки. Спирти. Поняття про функціональну групу.
Ми вже пригадували сьогодні, всі органічні речовини класифікують на:
вуглеводні , оксигеновмісні сполуки, нітрогеновмісні сполуки та вуглеводи.
Вуглеводні – саме слово, що означає? (вуглець і водень) а термін - оксигеновмісні , шо означає?
Тобто до складу молекул оксигеновмісних сполук входить атом оксисену.
Одним з найпростіших класів органічних оксигеновмісних сполук є спирти. Саме з цього класу розпочнемо вивчення оксигеновміснихорганічних речовин.
Кожен клас речовин відрізняється наявністю якихось атомів або груп атомів. Наприклад, в неорганічній хімії: кислоти – наявністю йона Гідрогену Н+, а основи – наявністю гідроксогрупи ОН-. Так і в органічній хімії речовини відрізняються один від одного різними атомами – функціональною групою.
Слайд 6
Отже, функціональна група - Функціональні групи — це групи атомів, що визначають хімічні й фізичні властивості речовин.
2. Насичені одноатомні спирти: загальна та структурні формули, ізомерія (пропанолів і бутанолів), систематична номенклатура.
Що ж це за сполуки - спирти?
Слайд 7
Історична довідка. Термін «спирти» виник в часи алхімії і застосовувався у відношенні до всіх летких речовин, які перетворювалися в «дух» (від лат. «spiritus» - дух).
Слайд 8
Спирти - органічні речовини, молекули яких містять одну або кілька функціональних гідроксильних груп, з’єднаних з вуглеводневим радикалом R
R-(OH)n
Спирти поділяються на одноатомні і багатоатомні. (за кількістю груп ОН)
І на насичені, ненасичені, ароматичні (за вуглеводневим радикалом)
Сьогодні ми ознайомимось з насиченими одноатомними спиртами.
Слайд 9
Назва спиртів складається з назви алкану з додаванням закінчення - ол
Ми вже знаємо, що загальна формула спиртів R-(OH)n
Якщо ми говоримо про одноатомні насичені спирти, то
Загальна формула Сn Н2n+1 ОН, де n – кількість атомів карбону в молекулі
Складемо гомологічний ряд спиртів. На попередніх заняттях ми вже ознайомились з поняттям гомолог і гомологічний ряд при складанні алканів чи алкенів.
(пояснення) - нагадаємо ряд алканів…
- Підставляємо в загальну формулу цифри від 1
Слайд 10
Щоб пояснити властивості спиртів нам потрібно розглянути будову молекул.
Слайд 11
Перед вами фрагменти моделів молекул
Атоми Карбону можуть утворювати ланцюги. Продовжимо карбоновий ланцюг на один атом, на два… (робота з моделями молекул алканів)
Утворюються нові молекули. Вони всі схожі з метанолом за будовою, а тому й властивостями.
Ізомерія спиртів… Слайд 12
Всі ізомери спиртів, так як і ізомери алканів чи алкенів потрібно називати за певними правилами, тобто переходимо до Номенклатури спиртів.
Пригадаємо, за якими визначеними міжнародними правилами ми складали назви насичених вуглеводнів….(вибираємо найдовший ланцюг….)
Слайд 13
3.Фізичні та хімічні властивості насичених одноатомних спиртів.
Перш ніж дати характеристику фізичним властивостям спиртів потрібно ще раз звернути увагу на будову їх молекул
Слайд 14
У гомологічному ряду спиртів немає газоподібних речовин на відміну від насичених і ненасичених вуглеводнів. Перші 10 членів гомологічного ряду – це рідини з специфічним запахом; спирти, що містять від 11 атомів Карбону– тверді речовини без запаху.
Демонстрація (розчинення етанолу у воді, горіння етанолу)
На прикладі етанолу охарактеризуємо наступні властивості: (з елементами демонстрації – позначено *)
1) агрегатний стан*;
2) колір*;
3) запах*;
4) розчинність у воді*;
Метанол – летка безбарвна рідина зі специфічним запахом. Температура кипіння 64,5 оС. Дуже отруйний, потрапляння 10 мл в організм людини спричиняє повну сліпоту, а 40-50 мл – смерть. Метанол – це сильна отрута, яка окислюється в організмі до формальдегіду. Формальдегід в свою чергу має перший клас небезпеки для людини і класифікується, як надзвичайно небезпечна речовина.
Ви мабуть чули в новинах про отруєння метанолом. За недавніми даними в Харківській, Донецькій, Луганській, Миколаївській і Житомирській областях від вживання сурогатного алкоголю зафіксовані майже сто випадків отруєнь фальсифікованим небезпечним алкоголем, із них майже половина випадків завершилися летально.
Хімічні властивості спиртів
Спирти проявляють як основні так і кислотні властивості. Слайд 16
Спирти взаємодіють з … Слайд 17
Слайд 18
1. Горіння спиртів (демонстрація) фарфорова чашка,вата, спирт, сірники
Етанол – легкозаймиста речовина. Змочимо вату 0.5 мл. етанолу помістимо її у фарфорову чашку та піднесемо запалений сірник. Спирт відразу ж загоряється й горить яскравим блакитним полум’ям.
. Під час горіння виділяється вуглекислий газ й вода:
C2H5OH + 3O2 → 2CO2 + 3H2O.
Скільки літрів кисню необхідно для спалювання етанолу масою 23 г?
2. Реакція часткового окиснення
Слайд 19
(Відео – «окиснення етанолу») Слайд 20
Якщо в спирт занурити розжарену мідну спіраль, покриту чорним нальотом купрум (ΙΙ) оксиду, то спіраль стане блискучою, з’явиться специфічний запах альдегіду. Цю реакцію використовують для якісного визначення спиртів.![]()
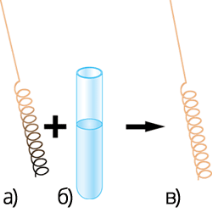
Якісна реакція на спирт.
а) розжарена мідна спіраль; б) спирт; в) відновлена спіраль.
3. Взаємодія спирту з лужними металами
Слайд 21
(віртуальна лабораторія)
При дії на спирти лужних металів відбувається заміщення Гідрогену гідроксильної групи на атом металу. При цьому утворюються алкоголяти. Алкоголяти, утворені метиловим спиртом, називають метилатами, етиловим спиртом –етилатами:
2C2H5OH (етанол) + 2Na → 2C2H5ONa (натрійетилат) + H2.
Спирти, подібно до води, бурхливо взаємодіють з металічним натрієм. Наступні спирти (пропіловий, аміловий) реагують слабше, а вищі реагують лише при нагріванні. З лугами спирти за звичайних умов алкоголятів не утворюють.
В суху пробірку поміщають невеликий шматочок металічного натрію (розміром з горошину), очищеного й просушенного фільтрувальним папером та доливають туди 2-3 мл спирту. До пробірки приєднують трубку з відтягнутим кінцем й підпалюють газ, що виділяється. Газ горить, отже це – водень.
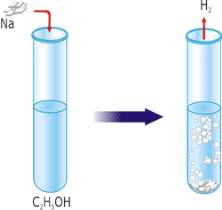
Рис. 55. Взаємодія етанолу з металічним натрієм.
4. Взаємодія спирту із галогеноводнями Слайд 21
У присутності водовіднімаючого засобу, такого як концентрована сульфатна кислота, спирти реагують із галогеноводневими кислотами з утворенням галогенопохідних насичених вуглеводнів. На відміну від попередньої реакції, при взаємодії спиртів з галогеноводнями в процесі бере участь ОН–группа повністю:
C2H5OH (етанол) + HCl → C2H5Cl (хлоретан) + H2O.
5. Дегідратація спиртів (внутрішньомолекулярна та міжмолекулярна)
Слайд 22
У присутності водовіднімаючогозасобу (концентрована сульфатна кислота, цинк хлориду) й підвищеної температури від молекул спиртів відщеплюється вода. Процес дегідратації може відбуватися двома різними шляхами, залежно від умов:
а) якщо дегідратація відбувається при нагріванні спирту (до 140°С) з достатньою кількістю концентрованої сульфатної кислоти, то відбувається утворення ненасиченого вуглеводню :
C2H5OH (етанол) ![]() CH2 = CH2 (етилен) + H2O;
CH2 = CH2 (етилен) + H2O;
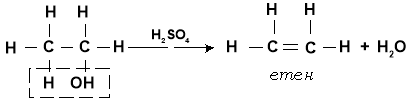
б) якщо дегідратація відбувається за вищої температури при надлишку спирту, молекула води відщеплюється від двох молекул спирту.
2C2H5OH (етанол) ![]() C2H5 – O – C2H5 (діетиловий етер) + H2O
C2H5 – O – C2H5 (діетиловий етер) + H2O
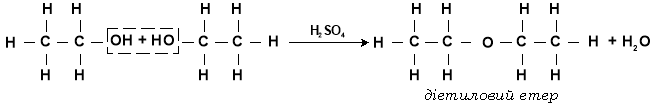
Загальна формула етерів R-O-R
У промисловості діетиловий етер одержують, пропускаючи пари спирту над алюміній оксидом при 250°С.
Етери – органічні речовини, молекули яких складаються з вуглеводневих радикалів, сполучених через атом Оксигену
Підсумок:
- Спирти є нейтральними речовинами й не дисоціюють на йони.
- При дії на спирти лужних металів відбувається заміщення атома Гідрогену гідроксильної групи на атом металічного елемента.
- При взаємодії спиртів з концентрованими галогеноводневими кислотами утворюються галогенопохідні вуглеводнів.
- Якісною реакцією на спирти є їх взаємодія з розжареним CuO – мідь відновлюється.
- Спирти піддаються дегідруванню й дегідратації.
4.Одержання етанолу
Слайд 23
Способи одержання
Етиловий спирт добувають трьома способами: спиртовим бродінням цукристих речовин, гідратація етену, гідроліз галогенопохідних алканів
Бродіння цукристих речовин
Спосіб бродіння цукристих речовин є найстарішим. Вихідною речовиною для цього способу служать природні продукти, багаті на крохмаль: картопля, зерна пшениці, жита, кукурудзи тощо, а також целюлоза.
Для перетворення крохмалю в цукристі речовини його спочатку піддають гідролізу. З цією метою розтерту картоплю або борошно заварюють гарячою водою, щоб прискорити набухання крохмалю, а потім додають солод, тобто розтерті з водою пророслі зерна ячменю. В солоді міститься особливий фермент (органічна речовина, що відіграє роль каталізатора), під впливом якого відбувається оцукровування (гідроліз) крохмалю, тобто перетворення його в глюкозу. Цей процес сумарно зображають таким рівнянням:
- nC6Н10О5 + nН2O = nC6Н12O6
Після закінчення процесу гідролізу до суміші додають дріжджі, під впливом яких глюкоза піддається бродінню, тобто перетворюється на спирт і діоксид вуглецю:
- C6H12O6 = 2C2H5—OH + 2CO2 ↑
По закінченню бродіння рідину піддають перегонці і одержують спирт-сирець, який містить близько 90% етилового спирту і різні побічні продукти — пропіловий спирт C3H7—OH, ізобутиловий C4H9—OH і ізоаміловий C5H11—OH (так звані сивушні масла), які надають сирцю неприємного запаху і роблять його отруйним.
Спирт-сирець ректифікують (очищають) розгонкою на спеціальних ректифікаційних колонках і одержують спирт ректифікат (очищений), який містить близько 96% етилового спирту і 4% води.
5.Застосування спиртів, дія на організм людини
Серед всіх спиртів найбільше значення мають метанол та етанол
ЕТАНОЛ
Алкогольні напої
Вони містять етиловий спирт. До них відносяться спирт, горілка, лікеро-горілчані вироби, ром, скроні, коньяки, виноградні і плодово-ягідні вина.
Спирт для харчової промисловості
Технологія: 1) одержання солоду; 2) приготовлений і зброджування солодкого затору; 3) перегонка зрілої бражки; 4) ректифікація зрілого спирту.
Харчова промисловість
Розчинник для харчових ароматизаторів. Застосовується як консервант для хлібобулочних виробів, а також у кондитерській промисловості.
Виробництво таких речовин: вибухових речовин; парфумів; нітроцелюлози та напівфабрикатів-спиртованих соків; морсів; настоїв; пектину; оцту спиртового; лікарських засобів; виноградних, плодових та інших виноматеріалов і сусла; синтетичного каучука; барвників; есенцій; фотоплівок; пороху; пластмаси.
Паливо
Для ракетних двигунів, двигунів внутрішнього згоряння в чистому вигляді; застосовується для вироблення високоякісного палива та компоненту бензинів - етил-трет-бутилового ефіру, більш незалежного від викопної органіки.
Хімічна промисловість
Служить сировиною для одержання багатьох хімічних речовин, таких, як ацетальдегід, діетиловий ефір, тетраетилсвинець, оцтова кислота, хлороформ, етилацетат, етилен та ін.; широко застосовується як розчинник; є компонентом антифризу і склоомивачів; у побутовій хімії етанол застосовується в чистячих і миючих засобах; є розчинником для репелентів.
Медицина: як антисептик; як знезаражувач; обробка операційного поля або в деяких методиках обробки рук хірурга; розчинник для лікарських засобів, для приготування настоянок, екстрактів з рослинної сировини та ін.; консервант настоянок і екстрактів; піногасник при подачі кисню, штучної вентиляції легень; в зігріваючому компресі; для фізичного охолодження при лихоманці (для розтирання); антидот при отруєнні етиленгліколем і метиловим спиртом; можливе застосування як компонента парентерального харчування (у вигляді 5% розчину) в ослаблених хворих з урахуванням високої енергетичної цінності речовини; компонент загальної анестезії в ситуації дефіциту медикаментозних засобів
Парфумерія та косметика
Є універсальним розчинником різних речовин і основним компонентом духів, одеколонів, аерозолів і т. п.
МЕТАНОЛ
Органічна хімія
— Як розчинник
Газова промисловість
— для боротьби з утворенням гідратів (з-за низької температури замерзання і хорошою розчинності).
Органічний синтез
— для випуску формальдегіду і формаліну, оцтової кислоти, ряду ефірів, ізопрену та ін..
Найбільша його кількість іде на виробництво формальдегіду, який використовується для виробництва фенолформальдегідних смол.
Лакофарбова промисловість
— Значні кількості CH3OH використовують у лакофарбовій промисловості для виготовлення розчинників при виробництві лаків.
Паливо
— метанол використовується для заправки гончих мотоциклів та автомобілів.
— Метил-трет-бутиловий ефір (C5H12O) застосовується як добавка до моторних палив, що підвищує октанове число бензинів (антідетонатор).
Парфумерія
— в якості денатуруючих добавкок до етанолу при виробництві парфумів
Висновок
— На прикладі етилового та метилового спиртів ми побачили ,що спирти у сучасному світі використовуються дуже широко. Багато предметів побуту виготовлені за добавок спиртів. Тому, щоб знати з чого виготовлені речі, що нас оточують, ми повинні уважно вивчати хімію.
На сьогоднішньому занятті вивчали новий клас оксигеновмісних речовин – одноатомні спирти. Підсумуємо вивчене..
Закріплення і узагальнення знань
Бліц-опитування
- Яку функціональну групу мають спирти?
- За якою ознакою спирти поділяються на одноатомні й багатоатомні?
- Що таке функціональна група?
- Які спільні хімічні властивості спиртів?
- Що спільне в застосуванні етанолу і гліцерину?
- Який спирт спричинює захворювання — алкоголізм?
- Назвіть типи хімічних реакцій, що характерні для спиртів?
- Про виявлення яких властивостей (кислотних чи основних) свідчить можливість взаємодії спиртів із лужними металами?
- Про виявлення яких властивостей свідчить можливість взаємодії спиртів із бромоводнем?
- Чи можна віднести спирти до кислот або основ? Чому?
Задача
Обчисліть об'єм водню, який виділиться в результаті взаємодії 46 г етанолу з надлишком металічного натрію. (11,2 л)
Слайд 28
Гра «Встав слово»
- Органічні речовини, до складу яких входить одна або кілька гідроксильних груп, називають спиртами.
- Спирти належать до оксигеновмісних органічних сполук.
- Функціональна група спиртів — це гідроксильна група.
- Спирти — це похідні насичених вуглеводнів, у молекулах яких один або кілька атомів заміщені гідроксильними групами.
- До складу насичених одноатомних спиртів входить вуглеводневий радикал і одна гідроксильна група.
- Спирти, в молекулі яких міститься лише одна гідроксильна група називають одноатомними спиртами.
- Назви спиртів походять від відповідних вуглеводнів з додаванням суфікса -ол.
Перевірка Слайд 29
2. «Впізнай мене» (Слайд 30) З переліку речовин вибрати формули спиртів:
С3Н7Сl, С2Н5OH, СН3СОOH, С2Н6, С2Н4, С3Н5(OH)3, С4Н7Br3, С2Н5OС2Н5.
3. «Моя структурна формула» (Слайд 31)
Зобразити структурні формули молекул спиртів із такими назвами:
а) 2-метилпентан-3-ол; б) 2,3-диметилгексан-2-ол
Тестування з теми (Слайд 32)
Вкажіть характеристичну (функціональну) насичених одноатомних спиртів
а) - ОН; б) - СНО; в) - СООН
- Вкажіть загальну формулу одноатомних спиртів
а) Сn Н2n+2; б) Сn Н2n+1COOH; в) Сn Н2n+1OH
- Вкажіть формулу етилового спирту
а) Сn Н2n+1СНО; б) С2 Н5 ОН; в) С Н3 ОН; г) С3 Н7 ОН
- Вкажіть формулу спирту, який є сильною отрутою
а) С2 Н5 ОН; б) С Н3 ОН; в) С3 Н7 ОН; г) С4 Н9ОН
- Вкажіть назву характеристичної групи в молекулах спиртів
а) карбоксильна; б) карбонільна; в) гідроксильна
- Систематичні назви спиртів утворюють від назв відповідних алканів з додаванням суфікса
а) - аль; б) - ол; в) - овий
- Атоми карбону в молекулі спирту нумерують з тієї сторони, де ближче
а) розгалуження; б) байдуже з якої сторони; в) зліва направо; г) функціональна група
- Мурашиний , або метиловий спирт в невеликій його кількості
а) викликає сліпоту; б) викликає смерть; в) є сильною отрутою
Перевірка (Слайд 33)
Домашнє завдання (Слайд 34)
- https://naurok.com.ua/test/oksigenovmisni-organichni-rechovini-26072.html
- https://sites.google.com/view/allhemi/медіатека/відеоексперименти-з-органічної-хімії
- https://www.bestreferat.ru/referat-388159.html
- Хімія (рівень стандарту): підруч. для 10 кл. закладів загальної середньої освіти/ П.П.Попель, Л.С. Крикля. – Київ: ВЦ «Академія», 2018.


про публікацію авторської розробки
Додати розробку
