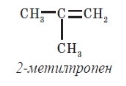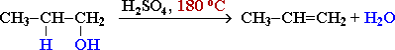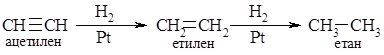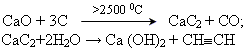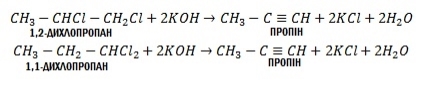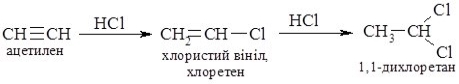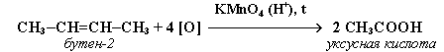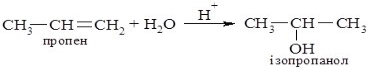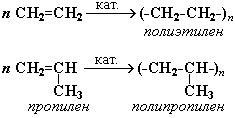Методична розробка лекції Тема: "Хімія алкенів і алкінів"
План та організаційна структура заняття
I. Тема заняття
II. Результати навчання :
- фахові компетентності
- загальні компетентності
III. Методи навчання
IV. Методи контролю
V. Міждисциплінарна інтеграція
VI. Література
VII. Підготовчий етап(30l )
VIII. Основний етап(40l )
IX. Заключний етап (10l )
Методична розробка лекції з хімії
I. Тема заняття:
Хімія алкенів і алкінів
І курс, “ Лікувальна справа”
Кількість навчальних годин – 2год.
Викладач: Смольницька Я.Д.
II. Результати навчання :
- фахові компетентності:
Знати:
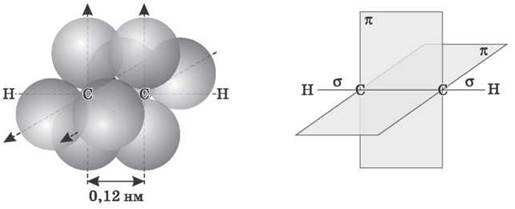
- природу потрійного зв`язку
- електронну природу потрійного зв`язку
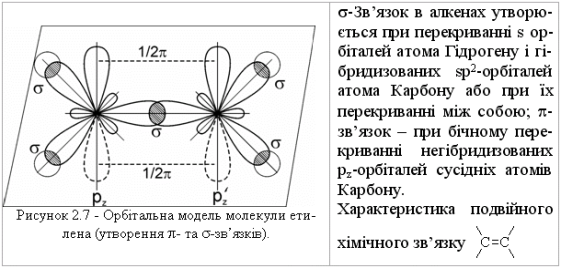
- σ – зв`язок(сігма)
- П – зв`язок(Пі)
- ізомерію
- хімічні властивості алкінів
- застосування етилену, поліетилену, поліпропілену, ацетилену
Вміти:
- називати сполуки з подвійними та потрійними зв`язками;
- писати формули за назвами ;
- складати ізомери, називати їх;
- писати реакцію приєднання;
- писати реакцію полімеризації;
- писати якісну реакцію на ацетилен;
- писати реакцію окиснення;
- писати реакцію одержання етилену, ацетилену;
- загальні компетентності:
- розуміти теорію будови органічних речовин О.М. Бутлерова
- писати рівняння реакції
- розуміти суть хімічного зв`язку
- знати класифікацію органічних речовин
Тип навчання:
Випереджуюча лекція з проблемними елементами та з поєднанням лекції-візуалізації
III. Методи навчання
1.Класичні:
- словесні: бесіда, пояснення, діалог
- наочні: ілюстрування, демонстрування
2.Сучасні:
- метод малих груп
IV. Методи контролю
- фронтальне усне експрес-опитування;
- фронтальне та індивідуальне опитування;
- ділові ігри;
- письмові самостійні роботи з використанням індивідуальних карток;
V. Міждисциплінарна інтеграція
|
Дисципліни |
Знати |
Вміти |
|
||
|
Українська мова |
Частини слова, складні слова |
Утворити складні слова |
|
Біологія |
Поширення в природі вуглеводнів |
Характеризувати склад, властивості нафти. Застосування нафтопродуктів. Складати план основних заходів охорони довкілля від забруднень при переробці вуглеводневої сировини та використанні продуктів переробки. |
|
Географія |
Поклади кам’яного вугілля; продукти коксування кам’яного вугілля, їх застосування. |
Характеризувати основні родовища кам’яного вугілля; застосування кам’яного вугілля. |
|
||
|
Біоорганічна хімія |
Хімічні властивості ненасичених вуглеводнів |
Писати рівняння реакцій, що характеризують хімічні властивості ненасичених вуглеводнів |
|
||
|
Органічна хімія |
Правила складання структурних формул органічних речовин |
Складати формули органічних речовин за назвою і навпаки. |
VI. Література
Основна:
1. А.В. Домбровський Н.І. Лукашова Хімія 10-11, – К.: Освіта, 1998. – 192 с.
2. А.С. Мороз, Д.Д. Луцевіч, Л.П. Яворська Медична хімія, – Вінниця: Нова книга, 2006. – 776 с.
3. Чернобельська Г.М., Чертков И.Н. Хімія, – М.: Медицина, 1993
4. Юзефович Р.В. Методичні рекомендації для практичних занять з хімії для студентів вищих медичних навчальних закладів І-ІІ рівнів акредитації. – Кіровоград: Центрально-Українське видавництво, 2011. - 149 с.
Додаткова:
1. Гольдфарб Я.Л. Збірник задач і вправ з хімії, – К.: Освіта. 1997.
2. Луцевич Д.Д., Березан О.В. Конспект – довідник з хімії, – К.: Вища школа 1997.
3. С.А. Неділько, П.П. Попель Загальна й неорганічна хімія (Задачі та вправи – К.: Либідь, 2001. – 400 с.
4. Чайченко Н.М. Основи загальної хімії. 11 клас. 1997.
5. Ярошенко О.Г., Новицька В.І. Збірник задач і вправ з хімії. – К.: Станіца 1996.
VII. Підготовчий етап
Мотивація навчальної діяльності
Вуглеводні — органічні речовини, аліфатичні, аліциклічні та ароматичні сполуки, до складу молекул яких входять лише атоми вуглецю і водню.
Вуглеводні утворюють гомологічні ряди. У природі вуглеводні зустрічаються в рідкому, твердому і газоподібному стані. У розсіяному вигляді присутні в атмосфері, воді, (кероген), в концентрованому — у покладах вугілля, нафти, газу, газогідратів.
Ненасичені вуглеводні в природних умовах є відносно нестабільними сполуками і тому практично не зустрічаються у складі горючих корисних копалин. Серед ненасичених вуглеводнів слід зазначити продукти полімеризації ізопрену (наприклад: природний поліізопрен, терпени), що виконують в живих організмах різноманітні біологічні функції.
У природі вуглеводні зустрічаються в рідкому, твердому і газоподібному стані.
Тоді ацетилен стали використовувати для освітлення. У полум'ї при високій температурі цей газ, що містить 92,3% вуглецю (це своєрідний хімічний рекорд), розкладається з утворенням твердих частинок вуглецю, які можуть мати у своєму складі від декількох до мільйонів атомів вуглецю. Сильно накалівая у внутрішньому конусі полум'я, ці частинки обумовлюють яскраве свічення полум'я - від жовтого до білого, в залежності від температури (чим гаряче полум'я, тим ближче його колір до білого).
У розсіяному вигляді присутні в атмосфері, воді, (кероген), в концентрованому — у покладах вугілля, нафти, газу, газогідратів.
Ненасичені вуглеводні в природних умовах є відносно нестабільними сполуками і тому практично не зустрічаються у складі горючих корисних копалин.
Серед ненасичених вуглеводнів слід зазначити продукти полімеризації ізопрену (наприклад: природний поліізопрен, терпени), що виконують в живих організмах різноманітні біологічні функції.
Матеріали методичного забезпечення підготовчого етапу заняття

Перевірка вхідного рівня знань
- Що таке алкани
- Який зв’язок характерний для алканів?
- Як називають алкани?
- Що таке гібридизація?
- Що таке sp3 – гібридизація?
- Які реакції характерні для алканів
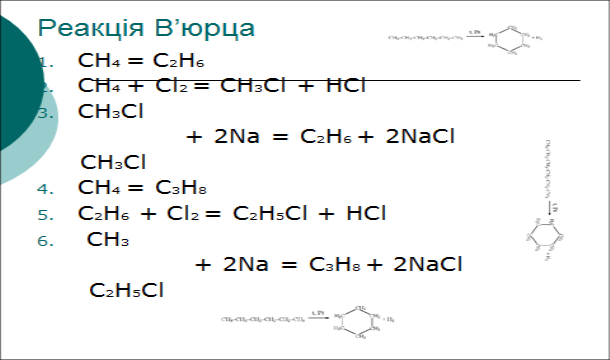
- Що таке реакція В’юрца?
- Де застосовують алкани.
- Як отримати дихлоретан?
- Як отримати хлоретан
I. Напишіть структурні формули:
1-бромбутан
2-бромбутан
1,1-дибромбутан
2,2-дибромбутан
II. 1) 2,5-диметилгексану
2) 3-метил-3 етилпентану;
3) 2-метил-4 етилгептану;
4) 3-метилпентану;
5) 2,2-диметил-3-етилоктану;
6) 2,2,3-триметилпентану;
Назвати формули сполук:
CH3 – CH – CH – CH – CH3
| | |
CH3 CH3 CH3
Завдання для 1-ї малої групи:
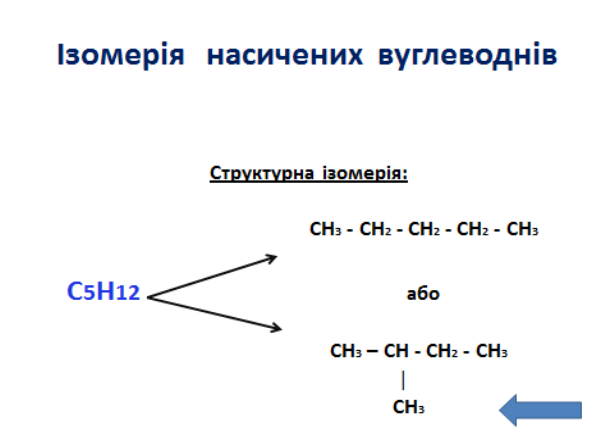
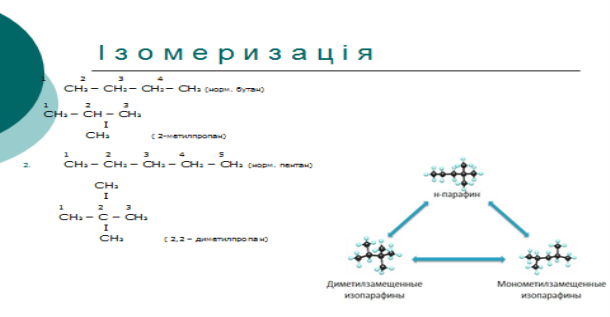
1. Алкани, гомологічний ряд . Номенклатура та Ізомерія.
Насичені вуглеводні – органічні сполуки, в молекулах яких всі атоми карбону сполучені одинарними зв’язками (σ-) і відповідають загальній формулі:
СnH2n+2
Алгоритм
- Вибір найдовшого ланцюга:
CH3 – CH - CH2 - CH3
│
CH3
2. Нумерація атомів найдовшого ланцюга:
1 2 3 4
CH3 – CH - CH2 - CH3
│
CH3
3. Утворення назви:
1 2 3 4
CH3 – CH - CH2 - CH3 2 - метилбутан
│
CH3

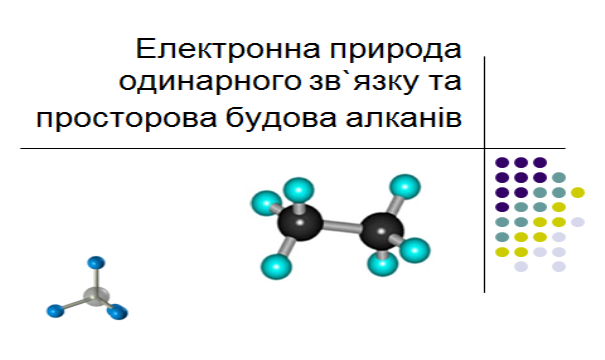
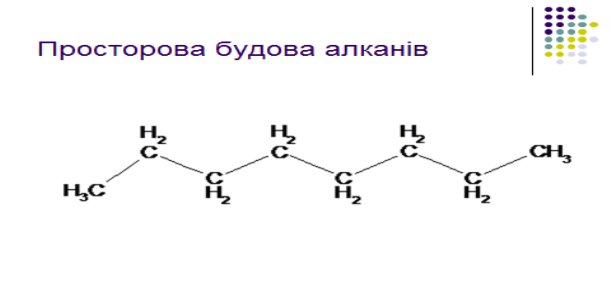
2.Електронна природа одинарного зв`язку та просторова будова алканів
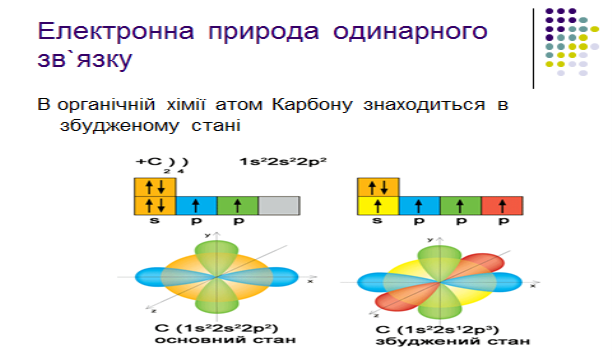
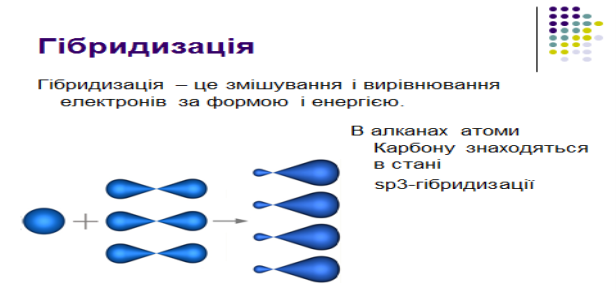
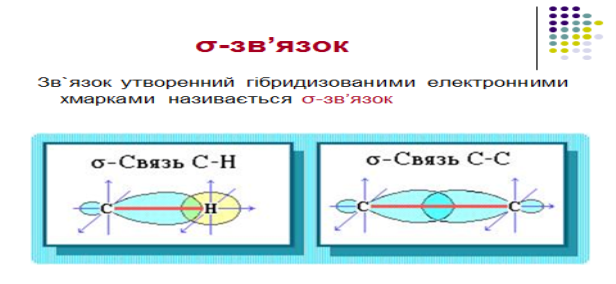

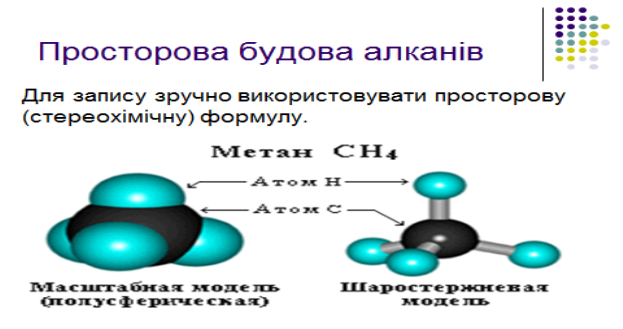
Завдання для 2-ї малої групи:
1.Хімічні властивості алканів






Завдання для 3-ї малої групи:






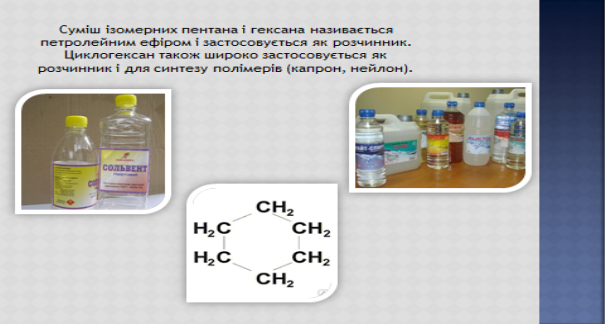

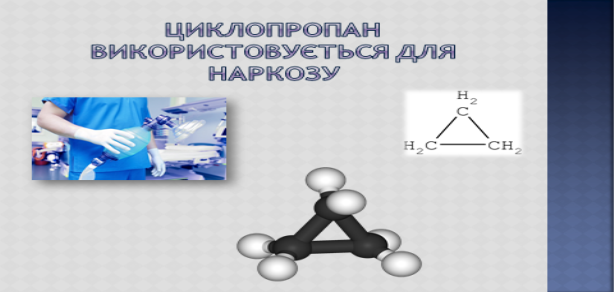


VIII. Основний етап
Етиленові вуглеводні із-за високої реакційної здатності – дуже цінна сировина в органічній хімії.
1)Етилен і пропілен широко використовують для одержання полімерів – поліетилен, поліпропілен, які йдуть на виготовлення пластмасових виробів, синтетичних волокон і каучуків.
2)Широко використовується етилен для виробництва етилового спирту.
3)Дихлоретан (CH2 Cl – CH2Cl) – безбарвна летка рідина із специфічним запахом, важко горить, пари отруйні. Є добрим розчинником жирів, смол, воску і інших речовин.
4)Хлоретан – C2H5Cl – кипить при 120 С, при невеликому охолодженні перетворюється в рідину, яка при t0 звичайній легко випаровується поглинаючи велику кількість теплоти. Ця властивість використовується в медицині при дрібних хірургічних операціях, коли потрібна місцева анестезія: краплини цієї рідини потрапляючи на шкіру, швидко випаровуються і сильно охолоджують місце оперування.
5)Етилен володіє цікавою властивістю – в його атмосфері швидше дозрівають плоди.
6)Пропілен використовують для синтезу гліцерину, спирту ...
7)Поліетилен – поліетиленова плівка, завдяки тому, що вона водо та газонепроникна її використовують для покриття теплиць, парників, як упаковочний матеріал, використовують в хімічному машинобудуванні.
8)Поліпропілен – використовується для виготовлення труб деталей холодильника, радіоприймачів.
9)Полівініл хлорид – використовується для ізоляції, для виготовлення труб, ліноліума, штучної шкіри, деталей апаратури.
10)Каучуки
11)Ацетилен використовують для:
а)для зварювання металів
б)для одержання оцтової кислоти(реакція
Матеріали методичного забезпечення основного етапу заняття

Структурно-логічна схема заняття
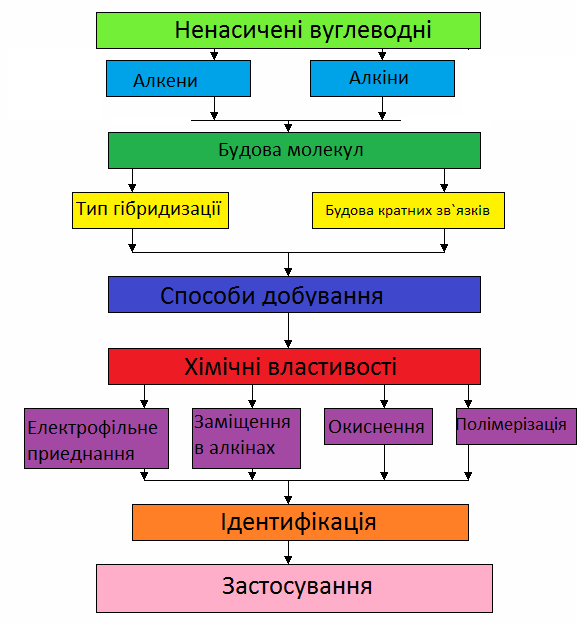
Зміст лекційного матеріалу
Вуглеводні поділяють на дві великі групи: на вуглеводні з відкритим ланцюгом вуглецевих атомів, які називають аліфатичними, і на вуглеводні з замкненим ланцюгом, які називають циклічними.
Аліфатичні вуглеводні, у свою чергу, поділяють на дві підгрупи: на насичені вуглеводні, в молекулах яких атоми вуглецю зв’язані між собою лише простими одинарними зв’язками, і на ненасичені вуглеводні, в молекулах яких між атомами вуглецю є подвійні і потрійні зв’язки.
Алкенами називають вуглеводні, в молекулах яких міститься один подвійний зв’язок С=С.
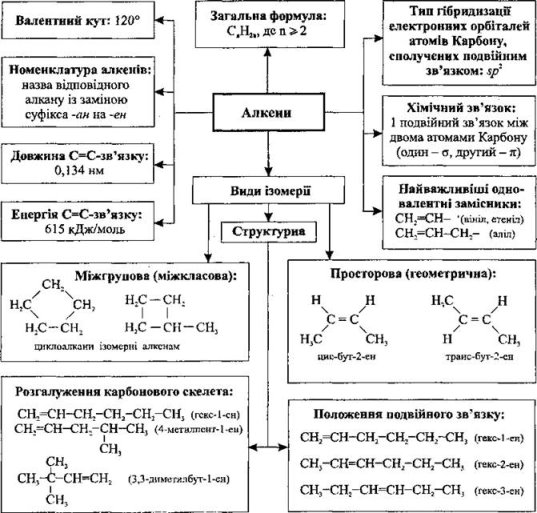
Їх також називають етиленовими вуглеводнями, або олефінами. Назва олефін (від франц. gaz olefiant - олієподібний газ) виникла ще в XVIII ст. від назви оліїстої на вигляд сполуки СН2С1-СН2СІ - “олії голландських хіміків”, що була отримана при взаємодії етилену з хлором.
Алкени утворюють гомологічний ряд формули СnН2n. Родоначальник ряду – етен (етилен) СН2=СН2.
За номенклатурою IUРАС назви алкенів утворюють від назв відповідних алканів заміною закінчення -ан на -єн. Головний ланцюг обов’язково повинен включати подвійний зв’язок, і його нумерацію починають з того кінця, ближче до якого розташований подвійний зв’язок. Положення останнього в ланцюгу молекули позначають цифрою - положенням вуглецевого атома, біля якого він знаходиться. Цю цифру прийнято ставити перед назвою головного ланцюга, але дозволяється і після суфікса -єн.
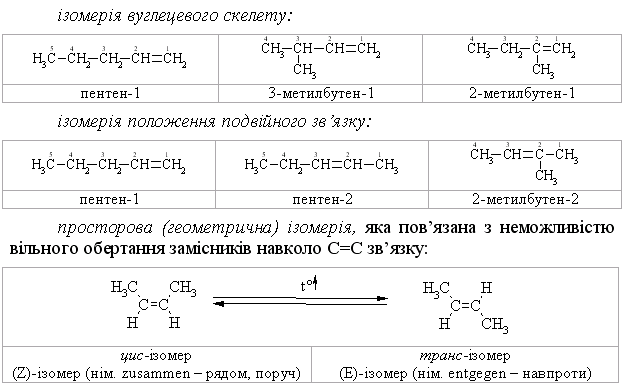
Структурна ізомерія алкенів пов’язана не тільки з розгалуженням вуглецевого скелета, але і з положенням подвійного зв’язку. Тому кількість структурних ізомерів для алкенів більша, ніж для алканів. Так, для гексену відомо 13 структурних ізомерів, для гептену - 27, у той час як для насиченого гексану - лише 5 структурних ізомерів, а для іншого алкану гептану - 9.
Крім структурної ізомерії для алкенів характерна також геометрична (Z, Е) ізомерія. Так, 2-6утен існує у вигляді цис- (а) і транс-ізомерів (б), які відрізняються значеннями фізичних констант.
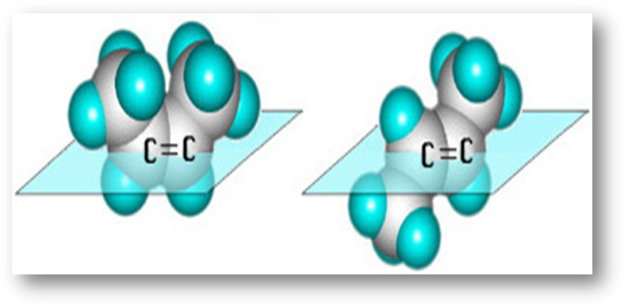
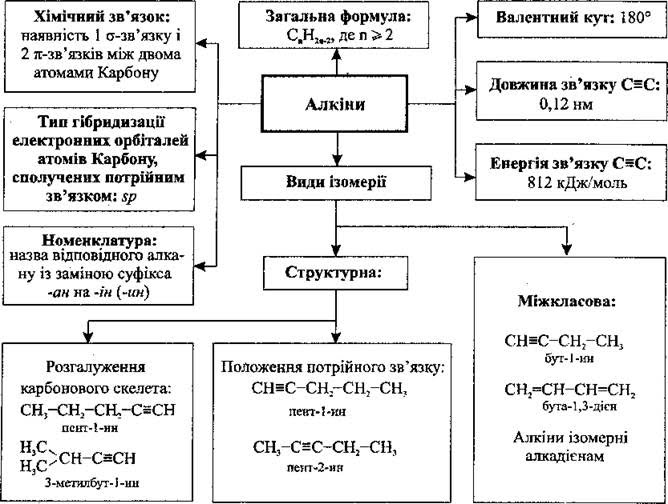
Алкінами, або ацетиленовими вуглеводнями, називаються сполуки, які містять один або більше потрійних зв’язків.
Алкіни з одним таким зв’язком утворюють гомологічний ряд загальної формули СnН2n-2, родоначальником ряду є ацетилен.
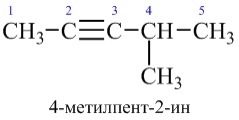
За номенклатурою IUPAC алкіни називають, замінюючи в алканах закінчення -ан на -ин (ін). Головний вуглецевий ланцюг повинен включати потрійний зв’язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний С=С-зв’язок. За раціональною номенклатурою алкіни називають як похідні ацетилену. Назви залишків алкінів утворюють шляхом додавання закінчення -іл до назви вуглеводню:
Ізомеризація алкінів пов’язана з положенням потрійного зв’язку та розгалуженням вуглеводневого ланцюга. Загальна кількість ізомерів для алкінів більша, ніж для відповідних алканів, але менша порівняно з алкенами.
Методи одержання алкенів
Промислові методи
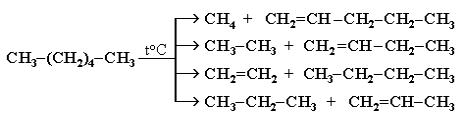
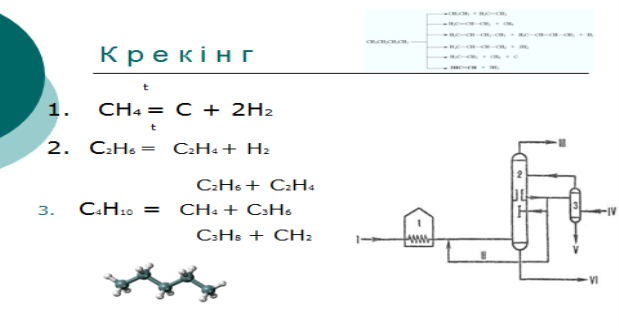
1. Крекінг алканів нафти
Лабораторні методи
1. Дегідратація спиртів:
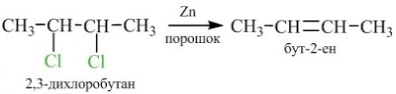
2. Відщеплення галогенів від дигалогенопохідних алканів:
3. Гідрування алкінів:
Методи одержання алкінів
Промислові методи отримання ацетилену
- Гідроліз ацетилениду (карбіду) кальцію:
2. Піроліз метану:
Лабораторні методи
1. Отримання з дигалогенпохідних:
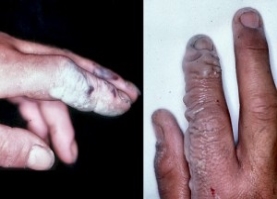
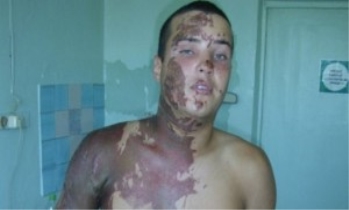
Отруєння сірчаною кислотою, сиптоми і перша допомога при вдиханні парів і опіках
Чим небезпечна сірчана кислота, отруєння, опіки
Сірчана кислота – це безбарвна, іноді світло-жовта рідина, по своїй структурі масляниста. Вона не має ніякого запаху і легко розчиняється у воді. Існує ще одна назва, історична — купоросное масло.
Як відбувається отруєння?
- При такому інтенсивному використанні, ситуації, коли можливе отруєння кислотою, трапляються нерідко.
- Сірчана кислота – надзвичайно небезпечна речовина, що вимагає уважного і обережного поводження
- Отруєння кислотою відбувається при контакті з нею і в рідкому стані, і у вигляді парів.
- Однаково сильно і досить важко переноситься отруєння в обох випадках.
Симптоми отруєння
- Отруєння сірчаною кислотою приводить до такого важкого стану, а симптоми так очевидні, що їх складно переплутати з отруєнням чимось іншим.
Отруєння парами
- Симптоми такого отруєння:
- Постраждалий отримує опіки очей різного ступеня тяжкості.
- Слизова органів дихання сильно травмується, в результаті виникають подразнення або опік. У важких випадках відкривається кровотеча з носа.
- Дихальна система уражається: виникають хрипи, сильні болі в горлі, можливий спазм. Небезпека для життя представляють саме спазм і подальший набряк легенів і гортані, які можуть становити реальну загрозу для життя потерпілого.
- Органи травлення також травмуються подразненнями і опіками.
Отруєння кислотою в рідкому вигляді
- Отруєння сірчаною кислотою в рідкому вигляді призводить до ще більш тяжких наслідків.
- Симптоми:
- Від концентрації кислоти залежить ступінь отриманих на шкірних покривах опіків і площа ураження всередині:
- При попаданні кислоти всередину: у всіх органах травної системи відразу ж виникає гостра біль, виникає блювота. Вона містить домішки крові і відрізняється багатством і темним кольором.
- Розвивається рясне слинотеча, що супроводжується сильним проносом.
- Сеча забарвлюється в червоний або темно-вишневий колір, що є свідченням сильного ураження нирок.
- Симптоми отруєння рідиною схожі з отруєнням парами – через деякий час розвивається набряк гортані, що дуже утруднює дихання.
- Шкірні покриви набувають синюшний відтінок.
- Починаються порушення в роботі серцево-судинної системи.
- Губи чорніють, на зубах виступають темно-бурі плями.
- Отруєння супроводжується сильним больовим шоком.
- Для смертельного результату цілком достатньо, щоб всередину потрапило всього 5 мг сірчаної кислоти.
Перша допомога
Якщо надати постраждалому своєчасну першу допомогу і невідкладно доставити його в медичний заклад, є шанси врятувати його життя і звести вплив кислоти до можливого мінімуму.
При попаданні всередину
- При отруєнні сірчаною кислотою з-за її потрапляння всередину, потрібно терміново промити шлунок водою (обов’язково кімнатної температури), потім дати потерпілому випити півсклянки олії. Пити його потрібно маленькими ковтками.
- В цьому випадку також ефективний прийом збитих яєчних білків, вапняного молока, паленої магнезії.
- Прийом всередину молока кімнатної температури і ковтання льоду також допомагають полегшити стан. Рот прополіскують содовим розчином.
При попаданні в очі
- При попаданні сірчаної кислоти в очі, їх потрібно відразу ж рясно і ретельно промити водою, після цього очі закапують двопроцентним новокаїном, щоб зменшити біль.
- Застосовують також масла, вазелінове або персикове масло закладають за повіки, дотримуючись, по можливості, стерильність.
При попаданні на шкіру
- При опіку шкірних покривів, їх відразу ж необхідно промити в проточній воді, досить довго — протягом як мінімум 10 хвилин. Можна застосовувати мило або лужний розчин.
- На уражену ділянку шкіри відразу після промивання водою накладають пов’язку, змочену содовим розчином.
Лікування отруєнь
Дати потерпілому проковтнути кусочок льоду і покласти лід на живіт, прополоскати рот 1%-им розчином калій перманганату або 2%-им розчином питної соди, молоко, яєчний білок, розчин крохмалю, чай.
В медичних умовах постраждалу слизову знеболюють пов’язками з новокаїном для зменшення больових відчуттів.
Новокаїн застосовують у вигляді внутрішньом’язових ін’єкцій.
Для запобігання розвитку інфекції в уражених органах призначають курс антибактеріальної терапії.
При розвинулися шлункових кровотечах здійснюють переливання крові, вводять плазму.
Заходи профілактики
Суворе дотримання заходів особистого захисту і правил техніки безпеки зводить ризик отруєнь кислотою до мінімуму.
Завдання для 1-ї малої групи
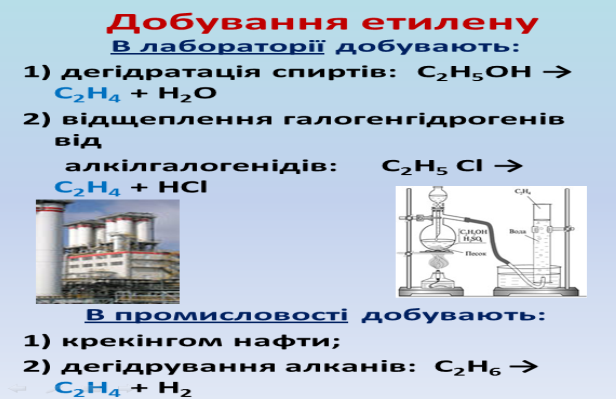
Газ етилен можна одержати відщепленням води від етанолу за присутності концентрованої H2 SO4 .
Кислота H2 SO4 є водовіднімаючою речовиною.
Готуєм суміш із 3 частин конц. H2 SO4 та 1 частини етилового спирту. Працювати з кислотою слід дуже обережно!(Кислоту лити в спирт, помішуючи скляною паличкою,а не навпаки). Отриманий розчин наливаєм в крапельну лійку,для того, щоб підливати невеликими порціями в колбу, в якій проходитиме реакція. Щоб суміш кипіла рівномірно в колбу слід помістити скляні трубочки. Реакція відбувається при нагріванні.
Для того,щоб зібрати виділений газ потрібен циліндр, наповнений водою. Циліндр поміщаєм в кристалізатор. Етилен з колби по трубочці потраплятиме прямо в циліндр.Етилен –безбарвний газ,малорозчинний у воді. Подивимось як горить етилен. Етилен згорає в повітрі з утворенням вуглекислого газу та води.
Реакція етилену з перманганатом калію.
Етилен для досліду одержуєм з концентрованої H2 SO4 та етилового спирту.
В пробірку наливаєм підкислений розчин перманганату калію . Опускаєм в пробірку газовідвідну трубку, через яку буде подаватись етилен з колби. В процесі реакції етилен буде окислюватись до двоатомного спирт- етиленгліколю, в результаті відбувається Знебарвлення розчину перманганату калію.
Ця реакція є якісною реакцією на подвійний зв'язок.
Взаємодія етилену з бром .
Чи буде етилен ,одержаний з етанола, в присутності конц. H2 SO4 взаємодіяти з бромом?
Пропустим одержаний етилен через розчин брому в воді.(бромну воду).Бромна вода швидко знебарвлюється. Бром приєднується до етилену, при цьому руйнується подвійний зв'язок.
Так,за допомогою бромної води можна визначити , що етилен є ненасиченим вуглеводнем.

Завдання для 2-ї малої групи

Ацетилен в лабораторіії одержують дією води на карбід кальцію. Карбід кальцію дуже активно взаємодіє з водою. Щоб уповільнити процес, замість звичайної води, використовуєм насичений розчин хлориду натрію. В колбу поміщаєм карбід кальцію.З крапельної лійки в колбу будем подавати насичений розчин хлориду натрію. Зразу ж починається виділення газу- це ацетилен. Другий продукт реакції гідроксид кальцію. Так ми отримали ацетилен дією води на карбід кальцію.
Горіння ацетилену.
В банку поміщаєм карбід кальцію. Якщо добавити до карбіду кальцію воду -утвориться газ ацетилен.
Отримаєм ацетилен та подивимось як він горить. Як тільки вода потрапляє на карбід кальцію, починається бурхливе виділення ацетилену. Ацетилен швидко витісняє повітря з колби .Газ виходить через тонкий отвір голки. Полум’я ацетилену дуже яскраве, тому що вміст карбону в газі дуже високий. Не згорілі частинки карбону підсилюють полум’я та осідають в вигляді сажі. Під час війни ацетилен використовували для освітлення.
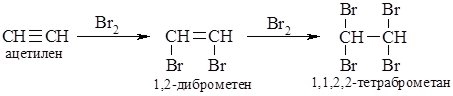
Взаємодія ацетилену з бромною водою.
Ацетилен одержуєм дією води на карбід кальцію. Подивимось, як ацетилен буде діяти на бромну воду.Для того щоб ацетилен виділявся не дуже швидко, замість води використовуєм насичений розчин хлориду натрію. Молекула ацетилену містить потрійний зв’язок. Бром руйнує її та приєднується до ацетилену. Утворюється тетраброметан- органічна речовина з чотирма атомами брому в молекулі . Бром витрачається на утворення тетраброметану і вода знебарвлюється. Знебарвлення бромної води доказує ненасиченість ацетилену.
Хімічні властивості алкенів
1. Реакція гідрування:
2. Реакція Вагнера (окиснення перманганатом Калію у лужному середовищ
3. Реакції окиснення перманганатом Калію у кислому середовищі:
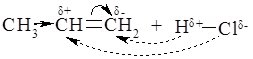
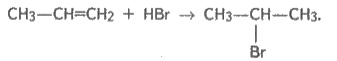
4. Реакції приєднання галогеноводнів:
Правило Марковнікова: У результаті приєднання галогеноводнів до несиметричних алкенів Гідроген приєднується до найбільш гідрогенізованого атому Карбону.
5. Реакції приєднання галогенів:
6. Реакції приєднання води (за правилом Марковникова):
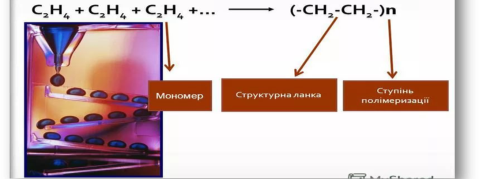
7. Реакції полімеризації

Хімічні властивості алкінів
- Приєднання галогенів (Cl2, Br2):
2. Приєднання галогеноводнів (HCl, HBr) за правилом Марковнікова:
3. Гідрогенізація:
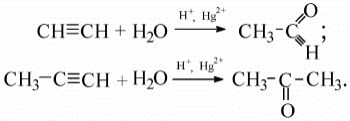
4. Реакція Кучерова (реакція приєднання води):
5. Реакція Реппе (тримеризація ацетилену):
6. Димеризація ацетилену з утворенням вінілацетилену:
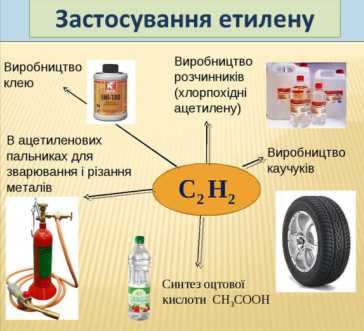
Застосування етилену та ацетилену
Етилен застосовують для добування етилового спирту, поліетилену. Він прискорює дозрівання плодів, коли вводяться невеликі його кількості в повітря теплиць. Продукт приєднання хлору до етилену, 1,2-дихлоретан є розчинником і засобом знищення шкідників сільськогосподарських культур. А продукт приєднання хлороводню - хлор етан - є анестезійною речовиною.
Ацетилен застосовується як вихідна сировина для багатьох промислових хімічних синтезів. З нього добувають оцтову кислоту, синтетичний каучук, полівінілхлоридні смоли. Продукт приєднання хлору до ацетилену - тетрахлоретан - є добрим розчинником жирів і багатьох органічних сполук. Ацетилен використовують для газового різання і зварювання металів.

IX. Заключний етап
Підведення підсумків заняття
Отже ми розібрали тему “Ненасичені вуглеводні“ зокрема такі класи сполук як алкени та алкіни.
Матеріали методичного забезпечення заключного етапу

Навчальні завдання для самостійної роботи
- 3,3-диметилбутен-1 взаємодіє з бромом. Напишіть рівняння реакції і назвіть продукти реакції за систематичною номенклатурою.
- Як взнати в якій посудині етилен, а в якій етан ?
- Зообразити структурні формули :
- 2,3-диметил бутен-1
- 3-етилпентен-2
- 2,3-диметил-3-етилгексен-1
- пентен-2
- 2,2,3,3-тетраметил гептен-4
- 2-метил бутен-2
- Назвати сполуки :
- CH3 – CH = CH – CH3
- CH3 – CH = CH – CH2 – CH3
- CH3 – CH2 – CH = CH – CH – CH3
|
CH3
CH3
|
d) CH3 – C – C = CH2
| |
CH3 CH3
e) CH3 – CH = C – CH2 – CH3
|
CH3
f) CH3 – CH – CH = CH – CH – CH3
| |
CH3 CH3
- За допомогою яких реакцій можна здійснити такі перетворення :
метан → етан → етилен → етиловий спирт
↙ ↘
1,2-дихлоретан хлоретан
- Який вуглеводень утвориться в результаті гідрування 2,3,4-триметилпентену- ?
- Які сполуки утворюються внаслідок таких перетворень ?
пентен-1 + Br2 → X + H2O → Y
- Зобразіть структурні формули таких вуглеводнів:
- 2,2-диметил гексин-3
- бутин-1
- пентин-2
- 3,3-диметилбутин-1
- 2,2,5-триметилгептин-3
- Складіть рівняння реакцій за допомогою яких можна здійснити такі перетворення:
метан → ацетилен → вуглець
↘
1,2-дихлоретан → 1,1,2,2-тетрахлоретан
Які сполуки утворюються в результаті взаємодії бутину-2 з такими речовинами:
а) воднем (у присутності каталізатора)
б) бромом
в) бромбоднем ?
Назвіть продукти реакції.
Напишіть структурні формули всіх ізомерів ацетиленових вуглеводнів складу С5Н8 і назвіть їх за системною номенклатурою.
В результаті взаємодії бутину-1 з хлорводнем добули речовину складу С4Н8Cl2 . Складіть рівняння реакції.
Складіть рівняння реакцій за допомогою яких можна здійснити такі перетворення:
![]() CaC2 → C2H2 → C2H4 → C2H5Cl
CaC2 → C2H2 → C2H4 → C2H5Cl
CHCl → [ - CH – CH - ]n
|
Cl
15) Які речовини утворяться, якщо пропустити ацителен крізь:
a)солену воду
б)розчин KMnO4(підкислений сульфатною кислотою)
Що спостерігаєте ? Відповідь підтвердьте рівняннями реакцій ?
16) Яким способом у лабораторії можна добути й зібрати ацетилен?
17) Які є способи промислового добування ацетилену ?
18) На прикладі взаємодії ацетилену з бромом поясніть електронний механізм реакції приєднання і зробіть узагальнюючий висновок.
19) Зобразіть структурні формули ізомерних ацетиленових вуглеводнів складу C4H8 і назвіть їх за систематичною номенклатурою. Чим зумовлюється ізомерія ацетиленових вуглеводнів ?
20) Зобразіть схему реакції М.Г. Кучерова – гідратації ацетилену в присутності солей ртуті.
21) Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення :
CH4 → C2H2 → вініл ацетилен(C2H4) → CH2=CCl-CH=CH2 →
→ хлоропреновий каучук
22)3,3-диметилбутен-1
CH3
|
CH2 = CH – C – CH3 + Br2 → CH2Br – CHBr – C(CH3)2 – CH3
| 1,2-дибром-3,3-диметилбутан
CH3
23)Треба пропустити етилен через бромну воду і розчин KMnO4.
Етан не буде взаємодіяти з розчином бромної води і розчином KMnO4, так як всі зв’язки насичені.
CH2 = CH2 + Br2 → CH2 – CH2 1,2-диброметан
| |
Br Br
Бромна вода знебарвлюється
CH2 = CH2 + H2O KMnO4 CH2 – CH2 етандіол-1,2
| | (етиленгліколь)
OH OH
Розчин перманганату K знебарвлюється
- 2,3-диметилбутен-1
CH2 = C – CH – CH3
| |
CH3 CH3
- 3-метилпентен-2
CH2 = CH – CH – CH2 – CH3
|
CH3
- 2,3-диметил-3-етилгексен-1
CH2 = C – C – CH2 – CH2 – CH3
| |
CH3 CH3
- пентен-2
CH2 = CH – CH2 – CH2 – CH
Тести
Завдання 1-9 мають по чотири варіатни відповідей. У кожному завданні лише ОДНА ПРАВИЛЬНА відповідь. Оберіть правильну відповідь та позначте її у бланку відповідей згідно з інструкцією.
- Впізнайте загальну формулу алкенів
а) СnH2n б) CnH2n-2 в) CnH2n+2 г) CnH2n+1
2. Вкажіть молекулярну формулу етену
а) С2Н6 б) С2Н2 в) С2Н4 г) С2Н5СІ
3. Впізнайте гомолог бутену
а) С3Н8 б) С3Н6 в) С3Н7СІ г) С5Н12
4. Згадайте суфікс з допомогою якого утворюються назви алкенів
а) –ан б) – ин в) – ен г) –ін
5. Вкажіть загальну формулу алкінів
а) CnH2n+2 б) CnH2n в) CnH2n-2 г) CnH2n+1
6. Згадайте тип зв’язку характерний для алкінів
а) одинарний б) подвійний в) потрійний г)ароматичний
7. Вирізнити з чого добувають етен у промисловості
а) целюлоза б) нафта в) крохмаль г)вугілля
8. Вирізніть гомолог етину
а) С3Н8 б) С3Н6 в) С3Н4 г) С2Н6
9. Вкажіть гібридизацію атомних орбіталей в алкенів
а) sp- б) sp2– в) sp3– г) s-
Завдання 10-14 мають на меті встановлення відповідності. До кожного стовбчика, позначеного цифрами, доберіть відповідник, позначений буквою, і впишіть їх в бланк.
10. Встановіть відповідність між загальними формулами та классами
вуглеводнів
1. CnH2n+2 а) алкени
2.CnH2n б) алкіни
3. СnH2n-2 в) алкани
11. Встановіть відповідність між молекулярними формулами та
назвами вуглеводнів
1. С3Н6 а) гексен
2. С5Н10 б) пентен
3. С4Н8 в) бутен
4. С6Н12 г) пропен
12. Встановіть відповідність між назвами та структурними формулами
вуглеводнів
1. 2-метилбутен-2 а) СН3 – С(СН3) = СН2
2. 2-метилпропен б) СН3 – СН = СН – СН3
3. 2-бутен в) СН3 – С = СН – СН3
4. 3-метилбутин-1 г) СН3 – СН – С СН
13. Встановіть відповідність між вуглеводнями та їх зв’язками
1. алкани а) потрійний
2. алкени б) одинарний
3. алкіни в) два подвійних
4. дієни г) подвійний
14. Встановіть відповідність між вуглеводнями та будовою гібридних
орбіталей
1. sp3– гібридизація а) алкіни
2. sp2– гібридизація б) алкани
3. sp-гібридизація в) алкени
В завданнях 15-18 розташуйте варіанти дій у правельній послідовності. Запишіть букви, якими позначені дії попорядку, у бланк
15. Встановіть послідовність збільшення молекулярних мас
а) гексен
б) бутен
в) етен
г) пентен
д) пропен
16. Встановіть послідовність
А) що містять в будові
Б) Вуглеводні,
В) називаються
Г) потрійний зв’язок
Д) алкінами.
17. Встановіть послідовність
А) подвійний зв’язок
Б) що містять в будові
В) називають
Г) Вуглеводні,
Д) алкенами.
18. Встановіть послідовність
А) речовини
Б) називають
В) Реакції відщеплення
Г) реакціями гідрування.
Д) водню від органічних
Завдання 19-30 передбачають певні обчислення і мають чотири варіанти відповідей. Оберіть правильну відповідь та позначте їх у бланку відповідей
19. Розрахуйте яку кількість кисню потрібно для повного згоряння 2 моль
етену
А) 44,8л б) 67,2л в)134,4л г) 192л
20. Вкажіть суму коефіцієнтів в рівнянні горіння етену:
А) 9 б) 8 в) 7 г)6
21. Вирізнити валентний кут в молекулі ацетилену
А) 109,50 б) 1800 в) 900 г) 1200
22. Встановіть число структурних ізомерів вуглеводню С4Н8
А) 1 б) 2 в)3 г) 4
23. Розрахуйте густину парів етену за воднем:
А) 28 б) 14 в) 7 г) 42
24. Зобразити молекулярну формулу вуглеводню якщо масові частки
Карбону і Гідрогену відповідно 85,7% і 14,3% , а густина за воднем 21.
А) С2Н4 б) С3Н6 в) С2Н6 г) С3Н8
25. Зобразити молекулярну формулу вуглеводню массою 4,2г, що
спалюють з утворенням Карбон (ІV) оксидом масою 13,2г. Відносна
густина пари цієї речовини за воднем – 42.
А) С6Н12 б) С6Н14 в) С6Н6 г) С6Н10
26. Розрахуйте об’єм ацетилену, який можна добути з 130 г кальцій карбіду, якщо масова частка домішок у ньому становить 10%.
А) б) в) г)
27. Віднайти молекулярну формулу етиленового вуглеводню
масою 5,6г , що приєднує 7,3г гідроген хлориду
а) С2Н6 б) С2Н4 в) С2Н2 г) С3Н6
28. Віднайдіть формулу органічної речовини при спалюванні 10г якої
утворюється 27,5 г вуглекислого газу і 22,5г води. Відносна густина
пари за киснем дорівнює 0,5
А) СН4 б)С2Н4 в)С2Н6 г)С2Н2
29. Розрахуйте який об’єм водню (н.у.) виділиться при дегідруванні 8,4л
циклогексану якщо практичний вихід водню 80%
А) 6,72 л б)3,66л в) 5,376л г) 22,4л
30. Віднайдіть формулу вуглеводню якщо внаслідок спалювання його
масою 8,8г утворилося 26,4 г карбон (ІV) оксиду. Маса 1л
речовини 1,96 г.
Питання для самопідготовки
1. Що таке подвійний зв`язок? Гомологічний ряд алкенів та алкінів.
2. Дайте визначення поняттям «ізомерія» та «номенклатура».
3. Охарактеризуйте правила складання назв ненасичених вуглеводнів.
4. Охарактеризуйте фізичні властивості алкенів і алкінів.
5. Опишіть будову молекули етилену. Конфігурацію sp2-гібридизованих атомів карбону.
6. Опишіть будову молекули ацетилену. Конфігурацію sp-гібридизованих атомів карбону.
7. Опишіть методи добування насичених вуглеводнів.
8. Опишіть методи добування ненасичених вуглеводнів.
9. Охарактеризуйте хімічні властивості алкенів і алкінів.
Оцінювання
Визначальними в оцінюванні рівня навчальних досягнень учнів з хімії є особистісні результати пізнавальної діяльності, в яких відображаються загальнопредметні компетентності, набуті учнями в процесі навчання.
За відмінностями між обсягом і глибиною досягнутих результатів, ступенем самостійності у виконанні завдань, здатністю використовувати знання у нових ситуаціях виокремлено рівні навчальних досягнень учнів, що оцінюються за 12бальною шкалою.
Кожний наступний рівень вбирає в себе вимоги до попереднього, а також додає нові характеристики.
При оцінюванні рівня навчальних досягнень з хімії враховується:
–
оволодіння хімічною мовою як засобом відображення знань про речовини і хімічні явища;
– рівень засвоєння теоретичних знань;
– сформованість експериментальних умінь, необхідних для виконання хімічних дослідів, передбачених навчальною програмою;
– здатність учнів застосовувати набуті знання на практиці;
– уміння розв’язувати розрахункові задачі.
Усі види оцінювання навчальних досягнень учнів здійснюються за характеристиками, наведеними в таблицях.
|
Рівні навчальних досягнень |
Бали |
Характеристика навчальних досягнень студента(студентки) |
|
Початковий |
1 |
Студент(студентка) розпізнає деякі хімічні об’єкти (хімічні символи, формули, явища, тощо) і називає їх (на побутовому рівні) |
|
2 |
Студент(студентка) описує деякі хімічні об’єкти за певними ознаками |
|
|
3 |
Студент(студентка) має фрагментарні уявлення з предмета вивчення і під керівництвом вчителя може відтворити окремі його частини |
|
|
Середній |
4 |
Студент(студентка) відтворює деякі факти, що стосуються хімічних сполук і явищ |
|
5 |
Студент(студентка) відтворює окремі частини навчального матеріалу, дає визначення основних понять |
|
|
6 |
Студент(студентка) послідовно відтворює значну частину навчального матеріалу |
|
|
Достатній |
7 |
Студент(студентка) відтворює навчальний матеріал, наводить приклади, з допомогою вчителя порівнює хімічні об’єкти |
|
8 |
Студент(студентка) логічно відтворює фактичний і теоретичний навчальний матеріал, застосовує знання в стандартних умовах, порівнює, класифікує хімічні об’єкти |
|
|
9 |
Студент(студентка) володіє знаннями основоположних хімічних теорій і фактів, наводить приклади на підтвердження цього, аналізує інформацію, робить висновки |
|
|
Високий |
10 |
Студент(студентка) володіє навчальним матеріалом і застосовує знання на практиці, узагальнює й систематизує інформацію, робить аргументовані висновки |
|
11 |
Студент(студентка) володіє засвоєними знаннями і використовує їх у нестандартних ситуаціях, встановлює зв’язки між явищами; самостійно знаходить, оцінює і використовує інформацію з різних джерел згідно з поставленим завданням; робить узагальнювальні висновки |
|
|
12 |
Студент(студентка) має системні знання з предмета, аргументовано використовує їх, у тому числі в проблемних ситуаціях; аналізує додаткову інформацію; самостійно оцінює явища, приймає рішення, висловлює судження, пов’язані з речовинами та їх перетвореннями |

про публікацію авторської розробки
Додати розробку