Урок "Захист і основні методи"
План-конспект, використаний у педагогічній діяльності при роботі із обдарованими учнями та для поглиблення свідогляду школярів. Може бути використаний при підготовці до ЗНО з предмту.
ПЛАН-КОНСПЕКТ заняття з теми:
«Корозія металів. Методи захисту металу від корозії»
Мета:
навчальна: з’ясувати причини виникнення корозії та збитки від неї; ознайомити з корозією металів як окисно-відновним процесом на прикладі корозії заліза; розглянути способи захисту металів від корозії та їх значення; розвиваюча: розвивати вміння порівнювати і робити висновки; продовжити формування в студентів вміння аналізувати матеріал отриманий з різних джерел інформації: підручника, додаткової літератури, презентації, складати опорний конспект з теми;
виховна: виховувати вміння працювати у складі групи, сприяти формуванню лідерських якостей, навичок логічного висловлювання своїх думок.
Тип заняття: лекція
Форми і методи роботи: розповідь, бесіда, діалог;
Обладнання: періодична система хімічних елементів, ряд активності металів;
Базові поняття та терміни: корозія хімічна та електрохімічна, пасивація, катодний та анодний захист, протекторний захист
Література:
- Каданер, Лев Ілліч. Фізична і колоїдна хімія : підручник / Л. И. Каданер. - Київ : Вища щкола, 1971. - 284 с
- Хомченко Г.П. Посібник з хімії для вступників до вищих навчальних закладів / Пер. з рос. - К.: Видавництво А.С.К., 2003.-480с
- Лебедєв С.Ю. Фізична хімія: навч. посіб. / С.Ю. Лебедєв.– Суми: Сумський державний університет, 2011. – 236 с.
Хід заняття
1. Організаційний момент. Мотивація навчальної діяльності
2. Повідомлення теми і завдань заняття
3. Основна частина заняття
4. Узагальнення і систематизація знань
5. Домашнє завдання.
План:
1 Корозія металів.
2 Методи захисту металу від корозії
1. Корозія металів. Електрохімічна корозія
Під дією навколишнього середовища метали руйнуються, перетворюючись в оксиди, гідрати оксидів та інші сполуки. Руйнування металів під дією навколишнього середовища називають корозією.
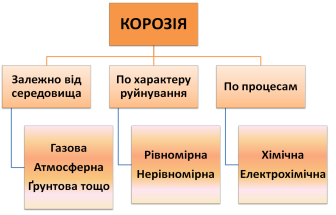
Хімічна корозія
Хімічна корозія – це процес руйнування металів в агресивних середовищах, що не проводять електричний струм, за рахунок хімічної взаємодії з оточуючим середовищем.
Під хімічною корозією розуміють руйнування металу при взаємодії його сухими газами або рідинами, які не проводять електричного струму. При нагріванні металів на повітрі більшість з них окиснюється. У деяких металів, особливо у заліза та його сплавів (чавун, сталь) оксиди утворюються у вигляді пористого шару, який не захищає поверхні металу від дальшого окиснення.
Під час хімічної корозії відбувається безпосереднє окислення металу окислювачами — компонентами навколишнього середовища.
Найнебезпечнішими для металів компонентами газового середовища є кисень О2, водяна пара Н2О, оксид вуглецю (IV) СО2, оксид сірки (IV) SO2. Корозійне руйнування заліза та його сплавів в атмосфері кисню зумовлене перебігом реакції. 4Fe+3О2=2Fe2О3
Наприклад, внаслідок дії водяної пари на залізо при високих температурах відбувається його хімічна корозія:
3Fe + 4H2O = 4H2 + Fe3O4,
Хімічну корозію поділяють на газову та рідинну. Газова корозія – процес окиснення металів сухими газами (SO2, Cl2, NхOу, O2, N2, CO2 та ін.). З підвищенням температури швидкість газової корозії зростає.
Рідинна корозія – руйнування металу в розчинах неелектролітів, наприклад, корозія свинцю в бензині, цинку в хлороформі та ін.
Електрохімічна корозія
Особливо великої шкоди завдає електрохімічна корозія. Вона спостерігається при контакті двох металів різної активності з водою чи іншим електролітом. Чисті метали електрохімічно не кородують. Однак, метали, які застосовуються в техніці, завжди містять домішки інших металів, які відрізняються за хімічною активністю. Тому, при контакті металу з розчином електроліту утворюється гальванічний елемент, в якому більш активний метал руйнується.
Опустимо металічний цинк в розчин хлоридної кислоти, (рис. 13.1). Цинкова пластина в кислоті перетворюється в позитивно заряджені йони, йони водню практично не відновлюються.
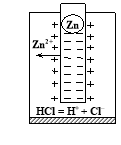

Схема процесів:
Zn0 + 2HCl → ZnCl2 + H20
Zn0 – 2ē → Zn2+
2H+ + 2ē ≠ H20 (процес майже не проходить).
Така корозія відбувається, як правило, за електрохімічним механізмом.
Під час електрохімічної корозії на металі відбуваються одночасно два процеси-окислення металу Me ( анодний процес):
![]()
і відновлення окислювачів-компонентів середовища Ох (катодний процес):![]()
Символ „Ох" означає „окислювач" (oxidator), „Red"- „відновник" (reductor).
В результаті окислення металу відбувається його розчинення.
Як правило, окислювачами у водних розчинах у кислому середовищі є іони водню ![]() або розчинений у воді кисень повітря. Так, корозія у кислому середовищі супроводжується таким катодним процесом:
або розчинений у воді кисень повітря. Так, корозія у кислому середовищі супроводжується таким катодним процесом:
![]()
Катодний процес під час корозії з участю кисню відбувається за рівнянням:
![]()
Як приклад розглянемо реакції, що відбуваються під час електрохімічної корозії заліза. Якщо корозія відбувається в розчині кислоти при pH менше 7, то відбуваються такі реакції:
![]()
![]()
![]()
![]()
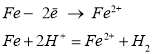
Корозія заліза в нейтральному або лужному середовищі характеризується такими реакціями:
![]() Fe-2e = Fe2+
Fe-2e = Fe2+
![]()
![]()
![]()
Таким чином, при електрохімічній корозії анодний процес – корозія більш активного металу, а катодний – деполяризація.
Фактори, що впливають на швидкість корозії:
- Чистота металу. Чим чистіший метал, тим менше на його поверхні мікрогальванічних елементів і тим повільніше йде корозія .
- Взаємне розташування металів, які складають корозійний елемент, в ряду напруження. Чим далі в ряду напруження знаходяться один від одного метали, з яких утворюється корозійний елемент, тим швидкість корозії більша.
3. Стан поверхні металу. Гладкі поверхні кородують повільніше, ніж шорсткуваті, тому що іони металу, що знаходяться на виступаючих частинах шорсткуватої поверхні, не так міцно з’єднані з основною масою металу і корозія починається на цих виступах
4. рН середовища. По відношенню до рН середовища спостерігаються два випадки:
а) при корозії металів, гідроксиди яких – основи, інтенсивність корозії зменшується із збільшенням рН середовища Це пов’язано з тим, що на катоді відбувається процес кисневої деполяризації:
К (+) 2Н 2О + О2 + 4е = 4ОН-,
при якому утворюються іони ОН- і відповідно принципу Ле-Шательє процес корозії зменшується в лужній області ( рН > 7 ).
б) при корозії металів, гідроксиди яких мають амфотерні властивості, інтенсивність корозії найповільніша в нейтральній області, особливо збільшується в лужній (рН = 8 -10) та кислій (рН <2) областях.
5. Концентрація кисню. Залежність швидкості корозії від концентрації О2 складна. Кисень в корозійних процесах виконує дві важливі функції:
- найважливіший деполяризатор;
- найважливіший пасиватор.
Пасиватори – це речовини, які окиснюють метал на поверхні, при цьому утворюється міцна плівка оксиду металу, яка захищає його від подальшої корозії.
6. Вологість. При атмосферній корозії зі збільшенням вологості збільшується швидкість корозії (процес деполяризації йде більш інтенсивно).
При ґрунтовій корозії збільшення вологості веде спочатку до збільшення швидкості корозії, а потім до зниження її. Зниження швидкості корозії починається в той момент, коли пори в грунті заповнюються водою, це перешкоджає доступу кисню до поверхні металу.
7. Гази в повітрі і домішки у воді. Гази, що викидаються промисловими підприємствами (NХOУ, сполуки S, Cl, CO2 та ін.), прискорюють корозію металу. В непромисловій місцевості корозія проходить повільніше.
Багато домішок в природній воді прискорюють корозію металевих споруд, що знаходяться під водою, особливо шкідливі речовини, що сприяють розчиненню оксидної плівки. Ці речовини називаються активаторами або стимуляторами. Прикладом таких речовин є хлор Cl-.
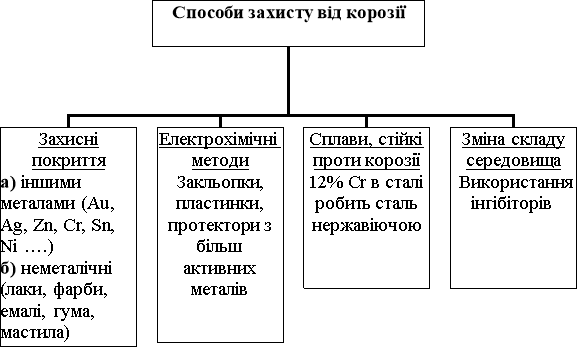
МЕТОДИ ЗАХИСТУ МЕТАЛУ ВІД КОРОЗІЇ
Для захисту металу від корозії застосовується багато різних методів, але немає єдиної класифікації, тому використовуємо одну з найбільш зручних, в якій всі методи поділені на чотири групи:
- захисні покриття;
- зміна складу металу;
- зміна складу середовища;
- електрохімічний захист.
Захисні покриття
Всі захисні покриття поділяють на три типи: неметалеві, металеві та хімічні.
Неметалеві покриття – це покриття, які наносяться лаком, полімерними плівками, асфальтом, гумою та ін. Забезпечують механічний захист від корозії.
Металеві покриття – це шар стійкого до корозії металу, який знаходиться на поверхні основного металу і захищає його від корозії.
Способи нанесення захисного металу на поверхню основного:
- гальванопокриття (наносять за допомогою електролізу);
Всі металеві покриття поділяють на два тип
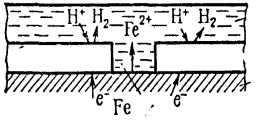
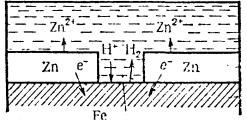 1) анодні покриття (рис. 1) :
1) анодні покриття (рис. 1) :
![]()
![]()
![]() A(-) Zn H 2O, O2 Fe K(+),
A(-) Zn H 2O, O2 Fe K(+),
A(-) Zn –2ē = Zn2+ - корозія
К(+) деполяризація.
Рис. 1. Анодне покриття
![]()
![]() 2) катодні покриття (рис.2):
2) катодні покриття (рис.2):
![]()
![]()
K(+) Sn H 2O, O2 Fe A(-),
A(-) Fe – 2ē = Fe2+ - корозія
K(+) деполяризація
Рис. 2 Катодне покриття
Анодні покриття на відміну від катодних після появи тріщин продовжують захищати метал від корозії.
Хімічні покриття – це покриття, що утворюються на поверхні металу при обробці поверхні різними хімічними реагентами. Це процеси:
- фосфатування;
- оксидування;
- борування;
- азотування та ін.
Наприклад, при фосфатуванні поверхню металу обробляють сумішшю мажеф (Mn(H2PO4)2, Fe(H2PO4)2) . При взаємодії цієї суміші з поверхнею утворюється густа міцна плівка сполуки фосфору, яка надійно захищає метал від корозії.
При оксидуванні на поверхні металу також утворюється міцна плівка оксиду, яка виконує захисну функцію. Базується на використанні інгібіторів корозії, застосовують органічні та неорганічні речовини.
Зміна складу металу
Зміну складу металу з метою запобігання від корозії можна здійснювати в трьох напрямках:
- очищення металу;
- антикорозійні добавки.
Наприклад, індій додають в невеликій кількості в сплави кольорових металів. При цьому підвищується корозійна стійкість металу; талій в сплавах оберігає метал від корозії в кислому середовищі.
- створення сплавів, стійких до корозії (нержавіюча сталь – 12% Cr, 8% Ni).
Електрохімічний захист
Існують протекторний і катодний електрохімічні захисти, які застосовуються тільки в середовищах, що добре проводять електричний струм.
Протекторний захист.
До металоконструкції на певній відстані приєднують частки більш активного металу в те ж середовище (Zn, Mg) (рис. 3).
![]()
![]()
![]()
![]() A(-) Zn Н2О, O2 Fe K(+)
A(-) Zn Н2О, O2 Fe K(+)
A(-) Zn – 2ē = Zn2+
K(+) 2H 2O + O2 + 4ē = 4OH-
Труба Zn
Рис.3 Протекторний захист металу
Розчиняється більш активний метал - протектор, на поверхні основного металу відбувається процес деполяризації. Термін роботи протектору в грунті до 10 років. Радіус дії протекторного захисту до 50 метрів.
 Для здійснення протекторного захисту до конструкції приєднують протектор у вигляді пластини або циліндра, який в даному середовищі володіє більш електровід’ємним потенціалом, ніж люба ділянка конструкції, що захищається.
Для здійснення протекторного захисту до конструкції приєднують протектор у вигляді пластини або циліндра, який в даному середовищі володіє більш електровід’ємним потенціалом, ніж люба ділянка конструкції, що захищається.
Для досягнення кращого ефекту протекторного захисту необхідно враховувати ряд факторів: конфігурацію конструкції, яка захищається, радіус дії протектора, який в значній мірі залежить від електропровідності середовища і ін.
Катодний захист.
Труба Рельс
Рис. 4 Катодний захист металу
Для нього використовуються джерела постійного струму. Постійний струм підводять до металевої конструкції (труба) так, щоб вона була катодом, до аноду приєднується рельс (рис.4). Відбувається процес електролізу з розчинним анодом. Руйнується металобрухт, але конструкція не страждає від корозії. Радіус катодного захисту до 2 км.
Катодний захист застосовується головним чином для захисту металічних конструкцій від корозії в умовах не дуже агресивних середовищ. Обов’язковим є наявність навкруги металічної споруди, що захищається, електроліту. Електроліт повинен оточувати конструкцію товстим шаром, щоб струм міг рівномірно розподілятися по всій металічній поверхні. Тому електрохімічний захист неефективний в умовах періодичного заповнення і спорожнення апарату і атмосферної корозії.
На ефективність електрохімічного захисту впливає також розміщення анодів. Вони повинні розміщатися так, щоб на поверхні конструкції, що захищається, був забезпечений струм рівномірної густини.
Питання для самоперевірки:
- Як поділяють захисні металеві покриття за способом їх захисної дії? Наведіть приклади.
- Які неорганічні речовини можуть бути використані як покриття на металах для захисту їх від корозії?
- Охарактеризуйте лакофарбові органічні покриття, назвіть їх позитивні якості та недоліки.
- Що таке інгібітори? Який механізм їх дії?
- Які види електрохімічного захисту? Яке їх призначення? Наведіть приклади.
Домашнє завдання: С. 200-207.
Корозія – це процес руйнування металів унаслідок їх хімічної взаємодії з речовинами довкілля.
![]()
![]() Види корозії
Види корозії
хімічна електрохімічна
4Fе+3О2+6Н2О → 4Fе(ОН)3 Метали руйнуються при взаємодії з сухими газами або рідинами неелектролітами 3Fe + 2O2 = Fe3O4 Mg, Al, Zn, Cr утворюють тонку оксидну плівку, що захищає метал. 2 Mg + O2 = 2MgO 4Al + 3O2 = 2Al2O3 4Cr +3O2 = 2Cr2O3
|
Руйнування металу супроводжується виникненням електричного струму у водному середовищі електроліта (завдає більшої шкоди)
4Fe + 3O2+ 6 H2O = 4Fe(OH)3 Іржа (бура) 2Fe+2H2O+O2 → 2Fe(OH)2 Fe(OH)2+H2O+O2→ Fe(OH)3
|
- Фактори які сприяють і уповільнюють корозію.
|
Сприяють корозії |
Уповільнюють корозію |
|
|
Що впливає на швидкість корозії?
Прискорюють корозію:
- Домішки менш активних металів, або контакт з ними.
![]()
![]()
![]()
![]()
![]()
![]()
Fe не ржавіє Fe іржавіє
Проблемне запитання:
Яке відро слугуватиме довше: луджене чи оцинковане відро?

Sn Zn
Довше буде слугувати оцинковане відро, оскільки цинк активніший за залізо.
- Характер середовища. Чим більш кисле середовище, тим швидше відбувається корозія.
NaCl посилює корозію, NaOH послаблює корозію, тому на морі металеві конструкції кородують швидше.
Протекторний захист: до конструкцію прикріплюють більш активний метал, який руйнується. Наприклад, корабель із пластиною магнію.
Радіус протекторного захисту 50 м

![]()
Електрозахист: конструкцію підключають до катода, а рейка із заліза – до анода, який руйнується. Радіус електрозахисту – 2000 м.

про публікацію авторської розробки
Додати розробку
