Урок з теми: "Короткі історичні відомості про спроби класифікації хімічних елементів."
№ 4
Тема: Короткі історичні відомості про спроби класифікації хімічних елементів.
Очікувані результати: учень усвідомлює значення прийому класифікації в науці;
обґрунтовує фізичну сутність періодичного закону; оцінює значення періодичного закону як одного із фундаментальних законів природи.
Тип уроку: засвоєння нових знань.
Методи навчання: словесні, наочні.
Клас: 8 клас.
Обладнання: Періодична система хімічних елементів Д. 1. Менделєєва.
Хід уроку
I. Організаційна частина.
II.Перевірка домашнього завдання.
ІІІ. Актуалізація опорних знань
- Які відомості можна знайти про хімічний елемент у періодичній системі?
• хімічний символ;
• назву;
• порядковий номер;
• атомну масу;
• будову атома.
IV. Мотивація навчальної діяльності.
Першими металами, на які людина звернула увагу, були самородні мідь і золото. Люди бронзового століття довідалися про існування заліза – більш твердого металу, ніж бронза. Важливу роль у розвитку хімії як науки відіграли філософи Давньої Греції.
Давні греки вважали, що основними елементами є вода, земля, повітря й вогонь. Кожен з елементів-стихій є носієм двох властивостей. Схема Аристотеля передбачала чотири комбінації: вогонь – гарячий і сухий, повітря – гаряче й вологе, земля – холодна й суха, вода – холодна й волога.
За 300 р. до н. е. в Олександрії були відомі сім небесних тіл, що постійно змінюють своє положення й тому названих «планетами» («мандрівними зірками»). І відомі сім металів: золото, срібло, мідь, залізо, олово, свинець і ртуть. Чому б не об'єднати їх у пари? Саме тоді золото почали співвідносити із Сонцем, срібло – із Місяцем, мідь – із Венерою. Марс-бог війни, йому підходить залізо. Або візьмемо відповідність «Сатурн - свинець ». Сатурн - уособлює принцип старіння, це зола вогню життя. Але не могли ж в середні століття знати, що свинець - попіл ядерного вогню, кінцевий етап багатьох ланцюжків ядерного розпаду. Аналогія «Венера - мідь» здається досить ясною: богиня краси Венера милується на себе в дзеркало, а мідь легко полірується, і за старих часів робили дзеркала із сплавів міді: бронзи або латуні.
Відомо, що розвиток будь-якої науки проходить етапи нагромадження і вивчення фактів, їх класифікації і виявлення зв'язків між фактами, встановлення певних закономірностей. Так само і в хімії. Окремі хімічні елементи були відомі за давніх-давен, коли хімії як науки ще не було. Проте наприкінці XVIII і особливо в XIX ст. число елементів почало стрімко збільшуватися. До середини XIX ст. вже було відомо 63 хімічні елементи, які утворювали сотні тисяч хімічних сполук. Нагромадження знань про хімічні елементи та їхні сполуки спричинило необхідність привести цю багатоманітність у певну систему. Тому тема сьогоднішнього уроку називатиметься: «Періодична систем хімічних елементів Д. І. Менделєєва.»
V. Вивчення нового матеріалу.
Передумови відкриття.
Поняття «система» у перекладі з грецької означає «ціле, складене з частин». Система відрізняється від простої суми частин тим, що в ній між частинами встановлюються взаємозв'язки і залежності. В системі знань про хімічні елементи також необхідно встановити залежність, природні зв'язки між відомими на той час елементами.
Одну з перших спроб класифікації хімічних елементів здійснив у 1804 р. шведський хімік Я. Берцеліус. Він поділив усі відомі тоді 32 елементи на дві групи – метали і неметали за відмінністю властивостей простих речовин. Але ця класифікація виявилася непридатною, оскільки вона не враховувала властивості перехідних металів, які утворюють амфотерні оксиди і гідроксиди, а тому посідають проміжне місце між металами і неметалами.
Пошуки тривали. Хіміки брали за основу класифікації хімічних елементів подібність властивостей простих і складних речовин, які вони утворюють. Так були виокремлені кілька родин подібних хімічних елементів.
Німецький учений Й. Деберейнер (1829) запропонував класифікувати елементи на тріади (по три елементи) за ознакою, коли атомна маса середнього елемента в тріаді дорівнює середньому арифметичному атомних мас крайніх елементів. Але далеко не всі атоми можна було описати такими тріадами.
![]()
У першій тріаді опинилися лужні елементи, у другій – лужноземельні, у четвертій – галогени. Розмістивши елементи у тріадах за збільшенням відносних атомних мас, Деберейнер помітив цікаву закономірність: напівсума відносних атомних мас двох крайніх у тріаді елементів приблизно чи точно дорівнювала відносній атомній масі «центрального» елемента. Покажемо це для першої тріади:
![]()
Крім того, властивості простої речовини та сполук цього елемента виявилися «проміжними» порівняно із властивостями простих речовин і сполук двох сусідніх елементів. Сформувати тріади з інших елементів Деберейнеру не вдалося.
Шанкуртуа у 1862 запропонував систематизацію хімічних елементів основану на закономірний зміні атомних мас - т. зв. «Земну спіраль» або «циліндр Бегуйе». Запропонована ним система базувалася на визначених у 1858 році італійським хіміком Станіслао Канніццаро правильних масах хімічних елементів. Систематизація Шанкуртуа представляла собою розвиток подібних диференціальних систем Жана Дюма і Макса фон Петтенкофера, які намагалися знайти у елементів співвідношення, подібні тим, що виявляються в гомологічних рядах органічних сполук, і відзначили, що атомні ваги деяких елементів відрізняються один від одного на величину, кратну восьми.
Шанкуртуа наніс на бічну поверхню циліндра, розмічену на 16 частин, лінію під кутом 45 °, на якій помістив точки, що відповідають атомним масам елементів. Таким чином, елементи, атомні ваги яких відрізнялися на 16, або на число кратне 16, розташовувалися на одній вертикальній лінії. При цьому точки, що відповідають подібним за властивостями елементів, часто виявляються на одній вертикальній лінії.
Систематизація Шанкуртуа стала істотним кроком вперед у порівнянні з існуючими тоді системами, проте його робота спочатку залишилася практично непоміченою; інтерес до неї виник тільки після відкриття періодичного закону. Шанкуртуа був одним з перших учених, які відзначили періодичність властивостей елементів; його гвинтовий графік дійсно фіксує закономірні відносини між атомними масами елементів.
У 1865 р. англійський учений Дж. Ньюлендс розмістив відомі тоді хімічні елементи у ряд за зростанням відносних атомних мас:
![]()
Він помітив, що в багатьох випадках кожний восьмий елемент є подібним до обраного за перший. Схожими були й відповідні прості речовини. Таку особливість має звуковий ряд у музиці: кожна перша і восьма ноти мають однакові назви і схоже звучання.
«Всі елементи при впорядкуванні їх за атомною масою повторюють хімічні властивості періодично у кожній восьмій позиції». Тому Джон Ньюлендс називає цю періодичну зміну Законом Октав. За часів Ньюлендса інертні гази не були відомими.
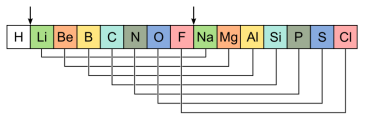
Закономірність, виявлену Ньюлендсом, назвали правилом октав. Вона спостерігалася на початку ряду елементів, але далі порушувалась.

Наприклад, Хром значною мірою відрізнявся від Алюмінію, а Манган і Ферум були зовсім не схожі на Фосфор і Сульфур відповідно. Число 8, як свідчить історія хімії, вважалося тоді магічним, але після з'ясування будови атома отримало наукове пояснення.
У 1857р. Ф. В. Гінрікс запропонував радіально – колову таблицю, де на кожному з одинадцяти радіусів були розміщені подібні елементи.
Німецький хімік Майєр найближче підійшов до відкриття періодичного закону. В 1964 році була надрукована схема в якій елементи були розподілені на 6 груп за валентністю. Але вчений не зробив ніяких висновків.
І лише в 1869 році світові була представлена періодична система якою хіміки користають і нині. Заслуга Д. І. Менделєєва полягає в тім, що виявлену залежність він зрозумів як об'єктивну закономірність природи, чого не змогли зробити його попередники. Завдяки відкриттю періодичного закону було виявлено, що всі елементи взаємозв'язані, підпорядковані єдиному закону і становлять єдину систему, яка справедливо була названа на честь ученого «періодичною системою хімічних елементів Д. І. Менделєєва».
Одним із способів зображення періодичної системи елементів є графічне (табличне) вираження періодичного закону хімічних елементів, так званий короткий варіант побудови періодичної системи.
Праця вченого в побудові періодичної системи.
Для побудови системи Д. І. Менделєєву довелося припустити інші значення відносних атомних мас майже у 20 елементів. Так, більшість учених вважали відносну атомну масу Берилію такою, що дорівнює 13,5. Однак за сукупністю властивостей Д. І. Менделєєв розмістив Берилій між Літієм і Бором, зробивши висновки, що відносна атомна маса Берилію має дорівнювати 9. Пізніше експериментальні дослідження довели справедливість припущення Д. І. Менделєєва.
Це було перше практичне застосування періодичної системи.
Будуючи періодичну систему, Д. І. Менделєєв залишив багато клітинок вільними. Серед 63 відомих тоді елементів ще не було таких, які за величиною відносних атомних мас і сукупністю властивостей могли б зайняти ці місця. Тим самим він довів, що повинні існувати елементи, котрі були ще невідомі. Він дійшов висновку, що їх властивості мають бути проміжними між властивостями сусідніх елементів, що розміщуються ліворуч і праворуч у тому самому ряду, й сусідніх елементів, що стоять вище і нижче. Це такі елементи, як Галій, Германій, Скандій. Д. І. Менделєєв назвав їх, відповідно, екаалюміній, екасиліцій та екабор.
Тріумфом періодичного закону було відкриття в 1875 р. французьким ученим Лекок де Буабодраном нового елемента, названого Галієм (на честь стародавньої назви Франції). Властивості Галію, визначені експериментально, повністю збігалися із властивостями екаалюмінію, передбаченими Д. І. Менделєєвим.
Впродовж наступних 15 років передбачення Д. І. Менделєєва блискуче підтвердились: були відкриті прості речовини, утворені передбаченими елементами.
Проте наприкінці XIX ст. були відкриті інертні гази (Не, Nе, Аг, Кг, Хе), їх молекули одноатомні. На відміну від усіх інших неметалів, вони не утворюють сполук із Гідрогеном і металами. Несподіване відкриття інертних газів стало важким випробуванням для періодичної системи, оскільки для них не було вільних клітинок. Д. І. Менделєєв утворив для них окрему групу (нульову), розмістивши інертні гази між галогенами і лужними металами. У результаті періоди набули свого логічного завершення. Все це зумовило загальне визнання періодичного закону і періодичної системи елементів.
VI. Закріплення знань.
Додаток 1
VII. Підсумок уроку.
Немає без явно вираженої працьовитості ні талантів, ні геніїв.
Д.І. Менделєєв
VІII. Домашнє завдання.
Додаток 1







про публікацію авторської розробки
Додати розробку
