Урок з теми: "Поняття про лужні, інертні елементи, галогени."
№ 5
Дата: _____________
Тема: Поняття про лужні, інертні елементи, галогени.
Очікувані результати: учень наводить приклади лужних, інертних елементів, галогенів, використовує інформацію, закладену в періодичній системі, для класифікації елементів.
Тип уроку: вивчення нового матеріалу.
Методи навчання: словесні, наочні, практичні.
Клас: 8 клас.
Обладнання: ПСХЕ Д. І. Менделєєва.
Хід уроку
I. Організаційна частина.
II. Перевірка домашнього завдання, мотивація навчальної діяльності.
- які способи класифікації хімічних елементів вам відомі?
- чому саме періодична система хімічних елементів Д. І. Менделєєва виявилася найдосконалішим зображенням класифікацій?
- особливості становлення періодичної системи хімічних елементів Д. І. Менделєєва
III. Вивчення нового матеріалу.
1. Лужні метали.
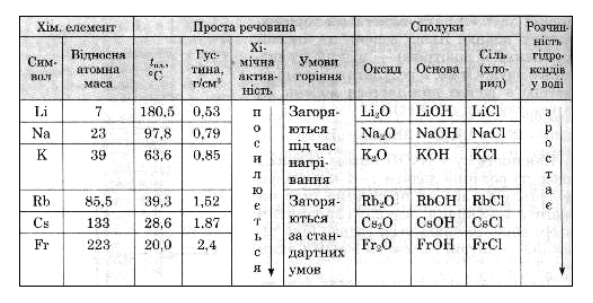
Лужні метали Літій Li, Натрій Na, Калій K, Рубідій Rb, Цезій Cs і Францій Fr знаходяться в головній підгрупі І групи періодичної системи хімічних елементів Д. І. Менделєєва. Практично найбільш важливі з них Натрій і Калій.
Лужні метали – це хімічні елементи з різко вираженими металевими властивостями.
Лужні метали завжди одновалентні.

Г. Деві (1778 - 1829) англійський вчений.
У 1808 році шляхом електролізу солей лужних металів отримав калій, натрій, барій, кальцій, амальгаму стронцію і магнію.
Г. Деві під час електролізу лугу КОН відкрив новий елемент, який він назвав потассіум, оскільки англійці називали КОН їдким поташем. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум'я. Так він і носився по воді, поки не перетворився на їдкий луг.
Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум'ям і тріском, навіть більш несамовито, ніж калій.
Фізичні властивості.
Всі лужні метали сріблястого кольору з незначними відтінками, легкі, м’які і легкоплавкі, легко ріжуться ножем, мають гарну електро- й теплопровідність, незначна густина (легші за воду). Їх твердість і температура плавлення закономірно знижуються від лілію до цезію.
Li, Na, K, Rb, Cs, t°кип і t°плавлення зменшуються (зі збільшенням атомної маси), густина збільшується, активність підвищується (щодо кисню й води).
|
|
|
Властивості лужних металів |
|
|
|||||||
|
Характеристики |
Літій |
Натрій |
Калій |
Рубідій |
Цезій |
Францій |
|||||
|
Символ |
Li |
Nа |
К |
Rb |
Сs |
Fr |
|||||
|
Атомна маса |
6,94 |
22,99 |
39,10 |
85,47 |
132,91 |
1223 |
|||||
|
Порядковий номер |
3 |
11 |
19 |
37 |
55 |
87 |
|||||
|
Валентність |
І |
1 |
І |
І |
І |
І |
|||||
|
Радіус атома, нм |
0,156 |
0,192 |
0,238 |
0,251 |
0,271 |
|
|||||
|
Густина, г/см3 |
0,53 |
0,97 |
0,86 |
1,52 |
1,87 |
|
|||||
|
Температура плавлення, °С |
179 |
97,8 |
6305 |
39 |
28,5 |
|
|||||
|
Температура кипіння, °С |
1 340 |
883 |
760 |
696 |
708 |
|
|||||
|
Агрегатний стан (н.у.) |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
|||||
|
Колір полум'я |
Червоно-коричневий |
Жовтий |
Фіолетовий |
Червоний |
Фіолетовий |
|
|||||
Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. Їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калію.
Хімічні властивості.
При хімічних реакціях атоми лужних металів віддають електрони зовнішнього енергетичного рівня і є відновниками. В усіх сполуках виявляють валентність -1. Зі збільшенням радіусів атомів енергія іонізації атомів зменшується і, як правило збільшуються їх хімічна активність.
Лужні метали енергійно реагують з усіма неметалами (лужні метали - Ме):
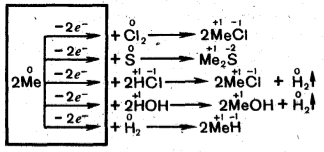
З водою літій реагує повільно, натрій значно швидше, а калій так швидко й виділяє стільки тепла, що водень, виділяючись, загоряється.
Взаємодія натрію з водою
Li, Na, K, загоряються на повітрі лише за нагрівання, а метали з більшою атомною масою без нагрівання.
В реакціях з киснем при горінні, лише Літій утворює оксид:
![]()
Решта лужних металів утворюють пероксиди:
![]()
Натрій пероксид
![]()
Метали можуть взаємодіяти одне з одним і утворювати так звані інтерметалічні сполуки, або металіди. Багато з них має важливе технічне значення. Металід SmCo5 – найкращий матеріал для сильних магнітів. Металів Nb3Ge – рекордсмен по надпровідності, AlSb i InSb – чудові напівпровідники.
Застосування.
Li – охолоджувач в ядерних реакторах;
- в металургії для видалення азоту, сірки;
- для отримання тритію:
![]()
Na - охолоджувач в ядерних реакторах у вигляді сплаву з калієм;
- в сплавах (з свинцем) для вкладишів підшипників;
- каталізатор в багатьох органічних синтезах;
- відновник при отриманні деяких тугоплавких металів;
- для отримання пероксиду натрію: Na2О2;
- виробництво мила.
К - охолоджувач в ядерних реакторах у вигляді сплаву з натрієм;
- для отримання пероксиду калію К2О2 – використовується на підводних човнах і космічних кораблях для поглинання СО2 і регенерації кисню, для тієї ж цілі пригодний Na2О2;
- в деяких органічних синтезах;
- виробництво мила.
Рубідій і цезій використовують для виготовлення фотоелементів – приборів безпосередньо перетворюючих світлову енергію у електричну.
2. Галогени
Галогени – F, СІ, Вг, І, Аt – типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. Їх назва походить від слів галос - «сіль» і ген - «той, що народжує».
Прості речовини F, СІ, Вг, І, Аt – складаються із двохатомних молеку F2, СІ2, Вг2, І2, Аt2.
|
Характеристики |
Флуор |
Хлор |
Бром |
Іод |
Астат |
|
Символ |
F |
СІ |
Вг |
І |
Аt |
|
Атомна маса |
19,00 |
35,45 |
79,90 |
126,90 |
210 |
|
Порядковий номер |
9 |
17 |
35 |
53 |
85 |
|
Валентність |
І |
І |
І |
І |
І |
|
Радіус атома, нм |
0,071 |
0,099 |
0,114 |
0,133 |
|
|
Густина, г/см3 |
1,11 |
1,56 |
3,12 |
4,94 |
|
|
Температура плавлення, °С |
-220. |
-101 |
-7 |
114 |
|
|
Температура кипіння, °С |
-188 |
-34 |
59 |
186 |
|
|
Агрегатний стан (н. у.) |
Газ |
Газ |
Рідина |
Твердий |
|
|
Колір |
Зеленкувато-жовтий |
Жовто-зеленкуватий |
Червоно-бурий |
Темно-фіолетовий |
|
Флуор – газ ясно-зеленого кольору, дуже отруйний. Активний неметал (у флуорі навіть вода горить), реагує з воднем за значного охолодження в темряві.
Хлор – важкий газ зеленого кольору з різким запахом, отруйний, за звичайних умов реагує з воднем-дуже повільно, а за температури або на світлі – з вибухом:
Н2 + СІ2 = 2НС1
Бром – важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор. З воднем реагує виключно за нагрівання.
Іод – темно-фіолетові кристали, активний неметал, найменш активний уряді галогенів, реакція з воднем навіть за нагрівання оборотна.
Запишемо кілька рівнянь, що характеризують хімічні властивості галогенів.
2Al + 3Br2 → 2AlBr3
2Na + Cl2 → 2NaCl
2Al + 3I2 → 2AlI3 (kat H2O)
3. Інертні елементи
Інертні елементи – це елементи головної підгрупи VIII групи періодичної системи. Не, Nе, Аг, Кг, Хе, Rn
|
Інертні гази |
|||||
|
Не |
Nе |
Аг |
Кг |
Хе |
Rn |
|
- безбарвні гази - без запаху і смаку - помірно розчинні у воді - за значного охолодження переходять у рідкий і твердий стани. |
|||||
З моменту відкриття газів – гелію, неону, аргону, криптону, ксенону та радону хіміки уперто й завзято боролися з їх пасивністю. Діяли на них активними металами і неметалами, агресивними хімічними сполуками, розжарювали до температури кілька тисяч градусів, охолоджували мало не до абсолютного нуля, діяли світлом і електричним струмом. Але марно. «Хімічні ледарі» не здавались, вони нізащо не хотіли вступати в хімічні реакції. Зневірившись, хіміки втратили будь-яку надію на успіх і зробили висновок, що інертні гази взагалі нездатні до утворення хімічних сполук. Така слава зберігалась за ними донедавна.
Сполуками «хімічних ледарів» марили не тільки вчені, але й письменники-фантасти. У романі «Війна світів» англійський письменник Г. Уеллс розповідає про війну, розв'язану космічними пришельцями-марсіанами на Землі. На румовищах своєї колишньої цивілізації земляни несподівано знаходять чорну речовину – смертоносну отруту, яка, буцімто, виявилась хімічною сполукою «ледачого газу» - аргону...
Хімічні сполуки Не та Nе не відомі, тому їх називають інертними, у той час як Кг і Хе утворюють хімічні сполуки.
«Штурм інертності благородних газів»
Що за горді, наче ружі,
І до всіх завжди байдужі,
Елементи в восьмій групі
Є у головній підгрупі?
Це спокійні, благородні
Гази, що з усіма згодні,
В поведінці неактивні,
У житті вони пасивні.
В назві їх ці всі моменти,
Це – інертні елементи.
Цікаво знати Гелій вчені спочатку виявили на Сонці, досліджуючи його спектр, і тільки через 13 років на Землі.
З кожним роком розширюється сфера застосування інертних газів. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окиснюються. Неоном, аргоном, криптоном і ксеноном заповнюють електричні лампочки. Суміш гелію з киснем застосовують для дихання під час підводних робіт. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Наприклад, аргон дає синє світіння, неон – червоне, тому їх використовують для світлових реклам і в маяках.
ІV. Підсумок уроку.
V. Домашнє завдання.


про публікацію авторської розробки
Додати розробку
