Уроки "Основні класи неоганічних сполук"
Розробка уроків
на тему
«Основні класи
неорганічних
сполук»
Урок №1
Тема: Оксиди: назва, будова, фізичні властивості, поширення у природі.
Мета: сприяти формуванню знань про оксиди, їх склад, будову, фізичні властивості;
Сприяти розвитку вмінь та навичок складати формули, називати оксиди за сучасною українською номенклатурою;
Виховувати людей з екологічним мисленням шляхом уявлення про негативний вплив деяких оксидів на навколишнє середовище.
Обладнання: зразки оксидів, періодична система елементів Д.І.Менделєєва, роздавальний матеріал.
Тип уроку: урок вивчення нового матеріалу.
ХІД ТА СТРУКТУРА УРОКУ
І. Організаційна частина.
ІІ. Мотивація.
Вчитель. Сьогоднішній урок мені хотілось би розпочати словами відомого французького письменника Е.Сент-Екзюпері : « Ти не маєш ні смаку, ні кольору, ні запаху, тебе неможливо описати, тобою насолоджуються, не знаючи, що ти таке ! Не можна сказати, що ти необхідна для життя - ти саме життя! »
Про яку речовину він сказав такі чудові слова? Як на вашу думку?
( Про воду.) А до якого класу неорганічних сполук належить ця речовина?
( Оксиди).
ІІІ. Визначення теми та завдань до уроку.
Учні самостійно визначили основне поняття теми - « Оксиди», а вчитель додає вторинні компоненти.
Учні визначають завдання до уроку:
- Знати визначення поняття оксиди;
- Навчитись складати формули та називати їх сучасною українською номенклатурою;
- Які фізичні властивості мають оксиди.
VІ. Актуалізація опорних знань.( Асоціація на дошці « Квітка» ).
Вчитель малює квітку : серединка із словом «оксид» та пелюстки, після цього він просить назвати прояви характеристики даного поняття й записує їх на пелюстках.
V. Вивчення нового матеріалу.
● Розповідь з елементами бесіди.
Вчитель пропонує згадати визначення поняття оксиди та загальну формулу ЕmОn.
Вчитель нагадує про різницю в поняттях «назви оксидів» та «прочитати формулу», про різницю між назвами оксидів з постійною та змінною валентністю. Для реалізації цього питання заповнюється таблиця на дошці та в зошитах .
|
Формула |
Як читається |
Як називається |
|
СаО |
Кальцій-о |
Кальцій оксид |
|
СиО |
Купрум –о |
Купрум (ІІ) оксид |
|
Fe2O3 |
Ферум-2-о-3 |
Ферум (ІІІ) оксид |
|
H2O |
Аш-2-0 |
Гідроген оксид |
● Первинна перевірка засвоєння знань.( групова робота).
- Напишіть можливі формули оксидів, які можуть відповідати такому складу : ЕО, Е2О, ЕО2, Е2О3, Е2О5, ЕО3, Е2О7, ЕО4, де Е- будь-який елемент. «Спікер» з кожної групи оголошує формули та записує їх на дошці.
- Дописати рівняння реакцій та назвати оксиди, які утворилися:
Mg +O2 =
N2 +O2 =
Cu +O2 =
● Самостійна робота.
Для опрацювання підтеми «Фізичні властивості оксидів» учням пропонується самостійно опрацювати ст.57 в підручнику О.Г.Ярошенко «Хімія» 8 кл. та дати відповідь на такі питання:
- В яких агрегатних станах можуть бути оксиди.
- Навести приклади оксидів з різними агрегатними станами.
- Які бувають за кольором оксиди. Навести приклади.
● « Екологічна хвилинка» ( тут може буде розповідь вчителя чи виступ Матінки природи – учениці старших класів ).
В результаті діяльності людини в повітря виділяються оксиди Сульфуру, Нітрогену та Карбону.
SO2 – газ з різким запахом, який негативно впливає на здоров’я людей та екологічну ситуацію в цілому.
Цей оксид під впливом певних чинників перетворюється на сульфур триоксид SO3, який, в свою чергу, унаслідок взаємодії з парами води, утворює сульфатну кислоту. Вона є основою так званих «кислотних дощів» , які негативно впливають на рослинний світ.
Сам оксид негативно впливає на здоров’я людини: знижується гемоглобін, виникають захворювання органів дихання та слизових оболонок очей.
Особливо збільшився вміст нітроген (ІV) оксиду. Це бурий отруйний газ, його називають ще «лисячий хвіст». Він теж являється причиною «кислотних дощів».
VI. Рефлексія.
Спробуйте оцінити свою роботу на уроці .
Вправа « продовж речення»
Сьогодні на уроці я довідався про …
Мені було цікаво дізнатися ….
Було важко….
Я зрозумів ….
Я навчився ….
VIІ. Підсумки уроку.
Оголошення оцінок за результатами роботи під час уроку.
« Те , що ми робимо для себе вмирає разом з нами. Те, що ми робимо для інших , для світу, залишається навіки.» Альберт Паш.
Ви сьогодні працювали на славу . Ті завдання , що ми поставили перед собою, з успіхом виконано. Бажаю Вам і в житті ставити перед собою завдання й з успіхом їх виконувати.
VIІІ. Домашнє завдання. &7, завдання1-4 ст.39.
Творче завдання: підготувати презентацію ( за бажанням) про будь - якого оксида за планом :
- Назва.
- Фізичні властивості.
- Хімічні властивості.
- Застосування .
- Значення для людини.
Урок №2
Тема: Поняття про кислоти. Класифікація кислот та їх фізичні властивості.
Мета: сприяти формуванню поняття про кислоти як представників основних класів неорганічних сполук, визначити за якими критеріями класифікують кислоти, ознайомити з фізичними властивостями кислот;
Розвивати вміння писати формули кислот ;
Виховувати здоров’язберігаючі компетенції під час роботи з кислотами.
Обладнання: колекція кислот, таблиця елементів, роздатковий матеріал - Пам’ятка щодо роботи з кислотами.
Тип уроку: комбінований
СТРУКТУРА ТА ЗМІСТ УРОКУ
І.Організаційна частина уроку.
Вітання до всього класу та створення робочого настрою.
ІІ. Перевірка домашнього завдання :
Дати визначення поняттям оксиди.
Яка загальна формула оксидів.
- Складіть оксиди з поданих елементів та назвіть їх : AI, Zn, S, Ca, Fe.
- Напишіть формули оксидів за назвами: ферум (ІІ) оксид, магній оксид, барій оксид, купрум (ІІ) оксид, калій оксид, сульфур ( VI) оксид, кальцій оксид.
Індивідуальні завдання біля дошки за завданнями з підручника на ст.39.
ІІІ. Мотивація навчальної діяльності.
Вчитель демонструє яблуко, лимон, листя щавлю, пігулки аскорбінки та пропонує визначити, що може об’єднати ці речі.(відповіді можуть бути різні, але одне із міркувань – кислі продукти). Що надає їм ці кислі властивості.
Кислоти. Тема уроку визначена. Великий Шекспір колись казав: «Від кислих яблук зразу скисну !»,- а я бажаю Вам сьогодні «не киснути» на уроці.
Далі учні пропонують свої завдання до уроку :
--- знати, що таке кислоти;
--- як класифікують кислоти,
--- які правила техніки безпеки під час роботи з кислотами.
IV. Вивчення нового матеріалу.
● Хімічний диктант.
Вчитель пропонує написати речовини та визначити спільні риси між ними : HCI, H2SO4, HNO3, H2SiO3, H3PO4, H2S.
Відповіді учнів сходяться до того, що всі речовини на початку мають атом Гідрогену та ще якусь частинку, яку за допомогою вчителя називають кислотним залишком. А далі учні вже самі дають визначення кислоти – це складні речовини, які містять атом Гідрогену та кислотний залишок.
Валентність кислотного залишку визначається за кількістю атомів Гідрогену.
● Демонстрація розчинів кислот та розгляд назв кислот у підручнику на ст.40.
● Вправа «Класифікуй кислоту».
На дошці вчитель вивішує картки з формулами кислот і просить учнів знайти спільні ознаки.
Наявність Оксигену чи його відсутність.
Кислоти
Оксигено
![]()
![]() вмісні
вмісні
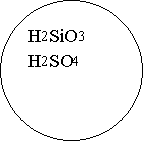
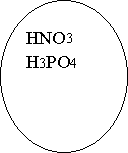
Кислоти
Безоксигенові
![]()
![]()
![]()
НІ HCI H2S.
● Кількість атомів Гідрогену.
Кислоти
![]()
![]()
![]()
Одноосновні Двоосновні Трьохосновні
НСІ, HNO3 H2SO4, H2S H3PO4
● Пам’ятка « Бережи себе!»
1. Кислоти небезпечні речовини, що призводять до хімічних опіків під час потрапляння на шкіру чи слизові оболонки!
2.Не можна куштувати кислоти на смак!
3. «Золоте правило» хіміків щодо розведення кислот :
Спочатку – вода,
А потім – кислота,
Бо буде велика біда !
- Нейтралізувати дію кислот можна розчином питної соди.
V. Закріплення знань.
● Гра « Хімічний хокей»
( Клас об’єднується в 2 команди і в черговому порядку відповідають на питання)
- Що таке кислота.
- На які групи поділяються кислоти.
- Назвіть склад кислот.
- Як визначити валентність кислотного залишку.
- Наведіть приклади одно - , дво -, трьохосновних кислот.
- Наведіть приклади оксигеновмісних та безоксигенових кислот.
- Які фізичні властивості мають кислоти.
- Назвіть правила техніки безпеки під час роботи з кислотами.
VI. Рефлексія.
( Вправа «мікрофон» ) :
- Чи вивчили ми поняття кислоти?
- Чи розглядали класифікації кислот?
- Чи знаєте як поводитись з кислотами під час роботи з ними?
- Чи складете формули кислот?
VII. Підсумки уроку.
Оцінювання роботи учнів за урок.
VIII. Домашнє завдання. § 8 ,ст.43 завдання 3.
( бажаючим скласти вірш чи казку про кислоти).
Урок №3
Тема: Солі: визначення, склад та фізичні властивості.
Мета : сприяти формуванню поняття про солі як представників основних класів неорганічних речовин, навчити складати формули солей; ознайомити із фізичними властивостями;
Розвивати навички та вміння писати формули солей;
Виховувати здоров’язбережувальні компетенції під час роботи з солями.
Обладнання: колекція солей, таблиця елементів та розчинності
Тип уроку: вивчення та первинного засвоєння нових знань
СТРУКТУРА ТА ЗМІСТ УРОКУ
І. Організаційна частина.
Логічна вправа «Постав на місце».
(учні дізнаються епіграф до уроку із хаотично записаних слів: хто, знайти, добре, все, вчити, того, хоче. ( Добре того вчити, хто хоче все знати.)
ІІ. Перевірка домашнього завдання.
● Вправа «Так чи ні».
--- Кислоти утворені з 2 елементів.
--- Кислоти класифікують за кількістю Гідрогенів та наявністю Оксигену.
--- Сульфатна кислота - трьохосновна кислота.
--- Валентність кислотного залишку нітрату - І.
--- Всі кислоти можна їсти.
● Робота з таблицею ( складіть формули кислот із символів ):
|
|
SO4 |
PO4 |
CI |
S |
CO3 |
|
Н |
|
|
|
|
|
ІІІ. Мотивація навчальної діяльності.
Розв’язати задачу біля дошки.
За рік людина з’їдає 6 кг повареної солі. Які масові частки елементів у цій сполуці?
Вчитель. Поварена сіль має величезне значення, тому її завжди багато добували у всьому світі, і наші чумаки їздили по сіль у Крим. Крім цієї солі є ще безліч, які ми сьогодні вивчим. Отже, тема уроку - «Солі».
IV. Визначення теми та завдань уроку.
( Методичний прийом «Лист до себе» ).
Учні в робочих зошитах пишуть завдання до уроку:
( можливі варіанти )
--- що таке солі,
--- які бувають солі,
--- чи всі розчинні,
--- чи можна їсти всі солі.
V. Актуалізація опорних знань:
1. Які класи неорганічних сполук вам відомі?
2. Дайте визначення поняттям оксиди, кислоти.
3. Які фізичні властивості мають кислоти та оксиди?
VІ. Вивчення нового матеріалу.
● Хімічний диктант.
Вчитель диктує формули солей, учні шукають спільні ознаки між ними
( мають атом металу та кислотний залишок ) .
Отже, учні самостійно дають визначення поняттю солі – це складні речовини, які утворені атомом металу та кислотним залишком.
Загальна формула
Ме n ( Кисл. Зал.)m
● Пам’ятка « Склади правильно формулу солі» :
- Записуємо атом металу та поряд кислотний залишок.
- Розставляємо валентності над металом та кислотним залишком.
- Знаходимо найменше спільне кратне та проставляємо індекси.
- Якщо валентність металу змінна, то її обов’язково враховують під час називання солі.
● Інтерактивна вправа «Спільний проект».
Правила техніки безпеки під час роботи з солями!
Учні об’єднуються в групи та досліджують фізичні властивості наявних солей, з подальшим оформленням роботи у вигляді таблиці ( опрацьовують ст.50-51) :
|
|
Агрегатний стан |
Колір |
Запах |
Розчинність |
|
Купрум ( ІІ) сульфат |
|
|
|
|
|
Натрій хлорид |
|
|
|
|
|
Кальцій карбонат |
|
|
|
|
|
Натрій карбонат |
|
|
|
|
VІІ . Первинне закріплення знань.
- « Упіймай помилку». Враховуючи валентність, визначити чи правильно складені формули солей :
II I I II II III
MgCI3, Na2CO3, KCI2, Ba(NO3)2, FeCI2, AISO4.
- «Хрестики – нулики»
MgCI2 BaSO4 Na2SO4
MgI2 KCI KI
KNO3 NaCI FeCI2
- Вправа «Запиши правильно сіль».
ферум (ІІІ) хлорид, магній нітрат, барій сульфат, калій карбонат, натрій силікат, кальцій сульфіт.
VІІІ. Рефлексія.
Вчитель пропонує повернутися до своїх завдань у вигляді «листа до себе» та відповісти на питання:
--- Чи всі записані завдання виконано.
--- Що співпало з вашими завданнями .
IX. Підсумки уроку.
X. Домашнє завдання §11, завдання 1-4 на ст.55.
Урок №4
Тема: Основи : поняття, склад і назви, класифікація.
Мета : сприяти формуванню поняття про основи як представників основних класів неорганічних сполук; навчити складати формули основ та давати їм назви, розглянути фізичні властивості основ і ознайомити з класифікацією основ за їх розчинністю;
продовжити розвивати навички та вміння класифікувати речовини за основними класами неорганічних речовин;
виховувати здоров’язберігаючі компетенції шляхом ознайомлення з правилами безпеки під час роботи з лугами.
Тип уроку: засвоєння нових знань
Обладнання: таблиці елементів Д.І.Менделєєва, розчинності, основних класів неорганічних сполук, зразки основ, засоби побутової хімії.
СТРУКТУРА ТА ЗМІСТ УРОКУ
Думати і діяти , діяти і думати –
ось мета нашої мудрості
Й.Гете
І.Організаційний етап.
Привітання та налаштування учнів на робочий лад.
ІІ. Актуалізація опорних знань:
● Методика «мозковий штурм»
1. Які класи неорганічних сполук же Вам відомі.
2. Що таке оксиди, кислоти, солі.
3. Які правила називання оксидів Вам відомі.
4.По якому принципу класифікують кислоти.
5. Як складаються формули солей.
● Вправа « Класифікатор» Дошка розділена на 3 графи : оксиди, кислоти, солі. Вчитель зачитує формули речовин, а учні розподіляють по розділах в таблиці та коментують свій вибір.
|
оксиди |
Кислоти |
Солі |
Приблизний список речовин :
СаО, СиО, H2SO4, Fe2O3, CuSO4, NaCI , BaCI2 , H2O, HCI ,H2SiO3 ,SiO2.
ІІІ. Мотивація навчальної діяльності учнів.
Вчитель. В побуті ми дуже часто використовуємо різні засоби для очистки забруднень різного походження. Це і « Кріт» для чистки каналізаційних труб, « Містер Мускул», який робить кухню чистою та привабливою. Але за правилами ми повинні користуватися гумовими рукавичками . Чому.
Щоб відповісти на це питання ми і вивчимо ще одну групу неорганічних речовин – основи.
Вчитель повідомляє тему уроку, а учні визначають завдання (приблизно такі)
- Знати поняття основи;
- Навчитись називати їх та правильно писати формули;
- Як правильно поводитись з основами .
ІV. Вивчення нового матеріалу.
● Хімічний диктант:
вчитель диктує формули різних основ, які учні записують на дошці і в зошитах, а потім пропонує проаналізувати речовини та знайти ознаки схожості ( всі мають – ОН групу). Далі вчитель пропонує учням самим створити визначення поняття «основ».
Основи – це складні речовини, які утворені металічним елементом та однією чи кількома гідроксильними групами – ОН.
● Пам’ятка « Як давати назви основам !»
- Якщо метал з постійною валентністю : метал + слово гідроксид ( КОН - калій гідроксид).
- якщо метал із змінною валентністю : метал + валентність + слово гідроксид
( Си(ОН)2 – купрум (ІІ) гідроксид ).
● Демонстрація колекції « Зразки основ».
● Самостійна робота над пунктом в підручнику «Фізичні властивості та класифікація основ» на ст. 54-55 ( О.Г. Ярошенко « Хімія»). Під час роботи над текстом учні паралельно працюють над складанням « спільного проекту » у вигляді таблиці:
Фізичні властивості основ:
|
Класифікація основ |
Колір |
розчинність |
Милкість |
|
Розчинні ( луги) |
|
|
|
|
нерозчинні |
|
|
|
● Правила техніки безпеки під час роботи з лугами :
Якщо крапля лугу потрапила на руку,
Мерщій лий на неї води великий струмінь,
А щоб нейтралізувати, то розчин оцту ще налляти,
І можеш серйозних опіків уникати.
V. Закріплення вивченого матеріалу.
(Робота в групах).
● Вправа « Третій зайвий»:
Яка речовина зайва в ряду : а) Mg(OH)2, MgCI2, Си(ОН)2;
б) Са(ОН)2, СаSO4, АІ(ОН)3;
в) Fe(OH)3, NaOH, Fe2O3;
г) Си(ОН)2, Mg(OH)2, NaOH.
Назвіть основи.
● Методичний прийом «Формула за назвою».
Напишіть формули за назвами речовин:
А) ферум (ІІ) гідроксид;
Б) калій гідроксид;
В) цинк гідроксид;
Г) Магній гідроксид;
Д) купрум (ІІ) гідроксид;
Є) хром (ІІІ) гідроксид.
IV. Рефлексія.
● Методичний прийом «Сніжна грудка».
( Слово – речення – питання – відповідь ).
Один учень промовляє слово по темі уроку ( наприклад, основа), наступний учень складає речення з цим словом ( наприклад, основа -неорганічна сполука ), інший учень створює питання до речення ( Що таке основа ?), четвертий – дає відповідь на нього).
V. Підсумки уроку.
Оцінювання учнів за діяльність на уроці.
VІ. Домашнє завдання. §11,ст. 53-55, завдання 1-3 ст.55.
Урок №5
Тема: Хімічні властивості оксидів. Класифікація оксидів. Застосування оксидів.
Мета: продовжити формування знань про основні класи неорганічних сполук, сприяти ознайомленню з основними хімічними властивостями оксидів, розширити знання про оксиди в природі;
Розвивати вміння на навички називати оксиди, записувати рівняння реакцій,
Виховувати навички культури хімічного спілкування.
Обладнання: набір реактивів для дослідів, таблиця елементів.
Тип уроку: комбінований
СТРУКТУРА ТА ЗМІСТ УРОКУ
І. Організаційна частина.
ІІ. Перевірка домашнього завдання.
● Робота з термінами : оксиди, кислоти, солі, основи.
● Вправа « Класифікатор».
Розподілити речовини по класах неорганічних сполук : Fe2O3, HCI, СаО, HNO3, H2O, H2SiO3, NaOH, AI(OH)3, H3PO4, H2S, AI2О3, , CuSO4, NaCI , BaCI2.
● Індивідуальні вправи за картками « Встановіть відповідність»:
1.Цинк оксид А) MgO
2.Сульфур ( ІV ) оксид Б)K2O
3.Магній оксид В) CO
4.Калій оксид Г)P2O3
5.Карбон ( ІІ ) оксид Д) SO2
6.Фосфор (ІІІ) оксид Є) ZnО
● Інформація про пошукову роботу учнів про використання оксидів у побуті.
ІІІ. Мотивація навчальної діяльності учнів.
Постановка проблемних питань:
1.Чи будуть оксиди взаємодіяти з водою? А може вони будуть в ній розчинятися?
2. А чи можуть оксиди між собою взаємодіяти?
3. З якими ще речовинами можуть реагувати оксиди?
ІV. Вивчення нового матеріалу.
Визначення теми та завдань до уроку.
Вчитель. Щоб дати відповідь на питання проведемо досліди.
Демонстрація 1. Взаємодія кальцій оксиду з водою.
У пробірку насипаємо 2-3 гр оксиду доливаємо води, перемішуємо і , щоб дізнатися , чи відбулася реакція доливаємо декілька крапель індикатора фенолфталеїну. Що спостерігаємо? ( малинове забарвлення). Про що це говорить? ( утворилася основа).
СаО +Н2О = Са(ОН)2
Отже, оксиди, яким відповідають основи, називаються основними.
ОСНОВНИЙ ОКСИД + ВОДА=ОСНОВА
Демонстрація 2. Взаємодія сульфур (ІV) оксида з водою.
У воду , в яку попередньо крапнули метилового оранжевого, пропустили газ сульфур (ІV) оксид, який був отриманий дією сульфатної кислоти на натрій сульфіт. Що спостерігаємо? ( індикатор змінив колір на червоний ). На що вказує ця зміна? Отримали кислоту.
Отже, оксиди, яким відповідають кислоти, називаються кислотними.
КИСЛОТНИЙ ОКСИД+ ВОДА =КИСЛОТА
Демонстрація 3. Взаємодія основного оксиду з кислотою.
Для досліду насипаємо на дно пробірки чорного купрум (ІІ) оксиду та доливаємо розчин хлоридної кислоти. Що спостерігаємо? Зміна забарвлення розчину. ( чорне на зелене,реакція відбулася).
СиО+2НСІ =СиСІ2 +Н2О
ОСНОВНИЙ ОКСИД+ КИСЛОТА=СІЛЬ+ВОДА
4. Взаємодія основних оксидів з кислотними.( Пам’ятка: щоб вірно написати рівняння необхідно пам’ятати , яка кислота відповідає кислотному оксиду.)
СаО + СО2 =СаСО3
ОСНОВНИЙ ОКСИД+ КИСЛОТНИЙ ОКСИД = СІЛЬ
5. Взаємодія кислотних оксидів з основами.( демонстрація)
У пробірку наливаємо кальцій гідроксид та пропускаємо вуглекислий газ, який повільно видихаємо через скляну трубку. Що спостерігаємо? Помутніння.
CO2 +Cа(ОН)2 = СаСО3 + Н2О
КИСЛОТНИЙ ОКСИД + ОСНОВА = СІЛЬ+ВОДА
● Робота з підручником над питання « Класифікація оксидів». Учні опрацьовують схему на ст..64 підручника О.І.Ярошенко та відповідають на питання :
1. В чому різниця між солетворними та несолетворними оксидами ?
2. Як класифікують солетворні оксиди?
3.Порівняти основні та кислотні оксиди.
4. Які особливості мають амфотерні оксиди?
V. Закріплення первинних знань.
( Робота в гетерогенних групах).
●1.Складіть рівняння реакцій :
А) H2SO4 +MgO = A)K2O+HCI=
Б) BaO+H2O = Б) MgO+ H2O=
В) SO3+ H2O= В) СО2+ H2O=
Г) Na2O+N2O5= Г) СаО+ H2O=
●2. Виберіть із наведених речовин ті, що можуть між собою взаємодіяти та напишіть можливі рівняння реакцій:
Сульфатна кислота, сульфур (ІV)оксид, гідроген оксид, натрій оксид, фосфор (V) оксид, магній оксид, хлорид на кислота.
●3.Вправа « Крокуючи лабіринтом».
VI. Рефлексія.
● Вправа «мікрофон»:
1. Чи відповіли ми сьогодні на проблемні питання?
2. Чи можуть оксиди взаємодіяти з водою? Чи всі оксиди реагують з водою?
3. Як класифікують оксиди?
VII. Підсумки уроку.
Оцінювання роботи учнів на уроці.
VIIІ. Домашнє завдання.§12-13,завдання 3-4 на ст.66., за бажанням виконати завдання 6.

Урок №6
ТЕМА: Хлоридна кислота.
МЕТА: сприяти ознайомленню учнів з хімічними властивостями хлоридної кислоти як представницею кислот, з якісною реакцією на кислоту та солі хлориди, закріпити навички проведення хімічного експерименту та складання хімічних рівнянь;
сприяти розвитку вмінь робити висновки за результатами хімічних досліджень;
сприяти вихованню доброзичливого ставлення під час роботи в групах .
ОБЛАДНАННЯ : розчин HCl, метилоранж, універсальний індикатор, магній, цинк, мідь, AgNO3, СиО, пробірки, таблиця «Застосування хлоридної кислоти»
Тип уроку: комбінований
Форма проведення : усний журнал
СТРУКТУРА ТА ЗМІСТ УРОКУ
І.Організаційний момент.
ІІ. Мотивація навчальної діяльності.
Сьогодні ми розпочнемо вивчати нову тему «Хлоридна кислота».На уроці ми повинні ознайомитись з хімічними властивостями хлоридої кислоти; вияснити, яка речовина може виявити хлоридну кислоту або її солі у розчині; повторимо вміння складати хімічні рівняння; розглянути застосування хлоридної кислоти.
Але спочатку хочу вас запитати : « Чи любите Ви читати журнали ?» Ось тому ми на уроці будемо читати журнал, який назвемо « Хлоридна кислота».
І.Сторінка журналу « Служба знайомств».
Ми з кислотами вже трохи знайомі з попередніх уроків, тому давайте пригадаємо: ( мікрофон):
Які речовини називаються кислотами?
Як кислоти класифікують за вмістом Оксигену?
Як кислоти класифікують за основністю ?
Як визначити валентність кислотного залишку?
Назвіть формулу хлоридної кислоти?
До якої групи за наявністю Оксигена належить HCl ?
Яка за основністю HCl ?
Як називається кислотний залишок та яка його валентність у хлоридної кислоти ?
Розповідь вчителя. Хлоридну кислоту за часів середньовіччя називали соляним спиртом .Вперше вона згадується у творах німецького алхіміка Василая Валентина в другій половині 15 ст.Алхіміки вивчали дію соляного спирту на метали й оксиди .Склад цієї речовини для вчених загадкою.
Тепер, щоб добути хлоридну кислоту необхідно спочатку добути газ хлороводень, який потім розчиняється у воді і утворюється хлоридна кислота :Рівняння реакцій добування кислоти учні записують у зошити
H2SO4+2NaCl=Na2SO4+2HCl
Який це тип реакції ?
ІІ.Сторінка журналу : « Обережно !»
Як потрібно поводитись під час роботи з будь-якою кислотою? ( Коли кислота потрапляє на шкіру чи слизисті оболонки слід промити спочатку проточною водою, а потім розчином соди). Назвіть «золоте правило» хіміків.
ІІІ.Сторінка журналу « Тест».
Test –з англійської «дослід, проба».Тести бувають навчальні, психологічні, а ми проведемо хімічні досліди з хлоридною кислотою.
Клас поділяється на 4 групи, кожній групі дається завдання для експериментального дослідження однієї із влостивостей хлоридної кислоти. Кожна група повідомляє про результати своїх досліджень усьому класу.
Перша група вивчає вплив хлоридної кислоти на індикатори.
Друга група вивчає вплив хлоридної кислоти на різні метали.
Третя група вивчає взаємодію хлоридної кислоти із основними оксидами.
Четверта група вивчає якісну реакцію на хлоридну кислоту та її солі.
По 2 учня від групи виходять до дошки. Один пише відповідне рівняння , інший демонструє дослід ,клас записує результати у робочі зошити.
ІV.Сторінка журналу «Реклама»
Який сучасний журнал без реклами ?Ми теж повинні прорекламувати хлоридну кислоту, тобто з’ясувати, де вона застосовується. (самостійна робота учнів над пунктом « Застосування» у підручнику.) з наступним обговоренням питання.
V.Сторінка журналу « Рефлексія».
Кожна група отримує завдання на картках, розв’язує їх , а потім по представнику від групи виходить до дошки і записують результати своєї роботи.
1.Напишіть рівняння реакцій по схемі :
Mg-→MgO-→MgCl2
Ca-→CaO-→CaCl2
Ba-→BaO-→BaCl2
Zn-→ZnO-→ZnCl2
2.Допишіть рівняння можливих реакцій:
Hg+HCl=
Ca+HCl=
Ag+HCl=
Mg+HCl=
VІ.Сторінка журналу « Епілог»
Учні виконують вправу «незакінчене речення»:
«Сьогодні я на уроці запам’ятав ….»
Домашнє завдання: § у підручнику.
Урок №7
Тема: Хімічні властивості основ
Мета: сприяти формуванню знань про хімічні властивості основ,
Розвивати вміння проводити хімічний експеримент та писати рівняння реакцій;
Виховувати здоров’язберігаючі компетенції під час роботи з реактивами Обладнання : набір реактивів для дослідів, таблиця розчинності
Тип уроку : формування знань, умінь та навиків
СТРУКТУРА ТА ЗМІСТ УРОКУ
Істина відкривається тим, хто її шукає.
Д.І.Менделєєв
І. Організаційний момент.
Привітання та створення позитивного настрою учнів на урок. Використовується методика « Я вітаю тих, хто …( хоче щось дізнатись нове, має гарну зачіску, гарно співає, має гарну краватку і т.д.)
Перевіряється виконання домашнього завдання із визначенням, які саме ускладнення викликали вправи.
ІІ. Актуалізація опорних знань
● Фронтальне опитування
- Що таке основи?
- Які правила складання формул основ?
- Як необхідно складати назви основ?
- На які групи поділяють основи в залежності від розчинності у воді?
- Яка різниця між лугами та нерозчинними основами?
● Тест-самоконтроль за темою « Основи».
1.Вкажіть назву речовини, яка має таку формулу Сu(ОН)2
А)калій гідроксид;
Б)магній гідроксид;
В) купрум (ІІ) гідроксид.
2. Серед формул: AI2O3, AI(OH)3, KOH, Na2O, K2SO4, Mg(OH)2, НСІ переважають формули: а) основи; б) кислоти; в) солі.
3. Вкажіть гідроксид, в якому валентність атома металу найбільша , а)Mg(OH)2, б) AI(OH)3 в)KOH.
4.Вкажіть валентність атома металу в гідроксиді складом Cr(OH)3:
А) І , Б) ІІІ, В) ІІ.
5. В якому ряду знаходяться лише основи :
А) K2SO4, Mg(OH)2, НСІ;
Б) AI(OH)3, KOH, Na2O;
В) LiOH, Mg(OH)2, Cu(OH)2.
6. Вкажіть формулу лугу:
А) AI(OH)3, Б) LiOH, В) , В)Cu(OH)2.
7. Вкажіть формулу нерозчинної основи :
А) Ва(ОН)2, Б) LiOH, В) , В)Cu(OH)2.
ІІІ. Мотивація пізнавальної діяльності.
Розгляд ситуації. У Ларисиній родині в квартирі сталася неприємна ситуація - забилася каналізаційна система. Тато дівчинки взяв засіб « Кріт», але рідина несподівано потрапила на руку. Батько промив руку проточною водою, а далі…. Що порадимо йому? Для цього ми повинні сьогодні дослідити хімічні властивості речовини.
ІV. Основний зміст уроку :
Групова робота над виконанням лабораторних дослідів з використанням інструктивних карток, з подальшим заповненням результатів у таблицю.
Перед початком дослідів проводиться інструктаж з техніки безпеки.
|
№ п\п |
реагенти |
Що робили |
Спостереження |
Рівняння реакцій |
Висновки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лабораторний дослід. Дія розчинів лугів на індикатори.
У 3 пробірки наливаємо по 1мл натрій гідроксиду, додаємо фенолфталеїн, лакмус та метилоранж. Що спостерігаємо? Результати записати в таблицю.
Лабораторний дослід. Взаємодія лугів з кислотами.
У пробірки із попереднього досліду додаємо краплинами хлоридну та сульфатну кислоти до повної зміни кольору індикаторів. Спостереження записати в таблицю.
На дошці записуємо рівняння реакцій
H2SO4+2NaOH=Na2SO4+2H2O
Вчитель пропонує записати рівняння реакцій між хлоридною кислотою та натрій гідроксидом. Потім вчитель разом з учнями визначають поняття « реакція нейтралізації» .
Лабораторний дослід. Взаємодія нерозчинних основ з кислотами.
А дно пробірки кладемо трохи порошку ферум (ІІІ) хлориду та доливаємо хлоридної кислоти до повного розчинення . Що спостерігаємо ? Спостереження та результати записати в таблицю.
Рівняння записується на дошці.
Fe(OH)3+3HCI=FeCI3+3H2O
Лабораторний дослід. Розкладання нерозчинних основ під час нагрівання .
У суху пробірку насипали купрум (ІІ) гідроксид, нагріваємо речовину, враховуючи правила нагрівання. Спостерігаємо за змінами, які записуються в таблицю .
Рівняння записується на дошці.
Cu(OH)2= CuO+Н2О
V. Закріплення отриманих знань.
Вчитель. Ми дослідили хімічні властивості основ, а тепер повернемося до нашого питання : чим допомогти Ларисиному батькові. Для цього перевіряємо за допомогою індикатора, до якої групи речовин належить вміст «Крота» (фенолфталеїн дав малинове забарвлення – основа). Отже, уражену частину потрібно обробити розчином борної чи оцтової кислоти.
● Вправа «Лови помилку».
Виправте помилки в рівняннях реакцій
А) ВаОН+НСІ=ВаСІ+Н2О;
Б) H2SO4+NaOH=NaSO4+H2O;
В) СО2+КОН=КСО3+Н2О;
Г) Zn(OH)2+HNO3=ZnNO3+H2O
VI. Рефлексія.
● Вправа « Продовж моє речення»:
Я сьогодні дізнався про …
Мені було цікаво …
Мені було складно…
Мені було легко…
VIІ. Підсумки уроку.
Оцінювання знань учнів.
VIІІ. Домашнє завдання. § 17, виконати завдання 3-5 на ст.85
( підручник О.Г.Ярошенко )
Урок №8
Тема: Поняття про амфотерні гідроксиди. Використання основ.
Мета : сприяти формуванню знань про амфотерні гідроксиди та їх властивості,
розвивати вміння писати рівняння реакцій,
виховувати здатність проявити свій артистизм та неординарне мислення .
Тип уроку : вивчення нового матеріалу
Форма проведення: урок-суд
Обладнання: таблиця «Класифікація основ»
СТРУКТУРА ТА ЗМІСТ УРОКУ
І. Організаційний момент.
ІІ. Мотивація навчальної діяльності.
Про які речовини ми будемо сьогодні говорити ? Щоб відповісти на це питання відгадайте загадку:
Ти в їхній формулі побач
Загальну групу цю—ОН,
Метал до неї ще додай.
Що буде , друже, відгадай?
Я бачу, відповідь готова:
Так виглядає в нас ……..( основа).
Ці речовини нам знайомі, то чому ж виникають суперечки? Існують особливі основи, проблеми яких ми спробуємо розв’язати.
ІІІ. Вивчення нового матеріалу.
Секретар. Увага! Всім встати! Суд іде! Сьогодні слухається справа про незвичну поведінку пана Цинк гідроксиду. Пані Кислота та пані Основа сперечаються щодо класової належності пана Цинк гідроксиду.
Суддя. Пане Цинк гідроксиду, доведіть до відома ваші паспортні дані.
Цинк гідроксид. Будь ласка!
Віддає таблицю , яка вивішується на дошці.
Назва : Цинк гідроксид.
Клас : Основи.
Формула: Zn(ОН)2.
Мr=99.
Фізичні властивості: біла, тверда, нерозчинна у воді речовина.
Цинк гідроксид. Я є громадянином Природничої країни, мешкаю серед району Хімія, в містечку Неорганія, на вулиці Основ.
Суддя. А чи маєте Ви родичів?
Цинк гідроксид. Ваша честь,на моїй вулиці багато мешкає моїх родичів, але найрідніші – це амфотерні гідроксиди - алюміній гідроксид, плюмбум (ІІ) гідроксид, берилій гідроксид.
Як і в будь-якої основи , наше ім’я починається з назви атома метала з додаванням слова «гідроксид», а якщо ще й валентність у метала змінна, то вона теж вказується.
Щоб мене добути (демонстрація досліду) необхідно налити розчин цинк сульфату й додати невеликі порції натрій гідроксиду до утворення білого осаду.
ZnSO4+2NaOH=Zn(OH)2+Na2SO4
Суддя. З паном Цинк гідроксидом ми мали честь познайомитися. А тепер перейдемо до нашого позивача пані Кислоти.
Кислота. Я висуваю до пана Цинк гідроксиду претензії в тому, що він на себе забирає мої властивості. Я маю докази .
( Демонстрація досліду)
У пробірку з цинк гідроксидом додаємо розчин натрій гідроксиду, осад поступово зникає.
Zn(OH)2+2NaOH=Na2{Zn(OH)4},(натрій тетрагідроксоцинкат)
Кислота. У цій реакції пан Цинк гідроксид відіграє мою роль – кислоти -, бо металічний елемент після реакції увійшов до складу кислотного залишку.
Основа – адвокат. Я протестую проти такого формулювання . Так , мій підзахисний може реагувати з лугами, але, як і основа, він взаємодіє з кислотами. Доказом моїх слів є наступний дослід. ( Демонстрація досліду : до пробірки з цинк гідроксидом додати хлоридної кислоти, осад зникає.
Zn(OH)2+2HCI=ZnCI2+2H2O
Суддя. Виходить , що пан підсудний проявляє подвійні властивості.
Я кожного вислухав, і оголошую свій вирок Цинк гідроксиду . Отже, згідно всім доказам, вирішено визнати пана Цинк гідроксида амфотерним гідроксидом, тим який проявляє як основні . так і кислотні властивості.
Чим же так важливі Цинк гідроксид та його родичі, що так було здійснено багато галасу? Пропоную присяжним надати інформацію про значення різних основ.
( Учні в ролях присяжних інформують клас про значення основ.)
IV. Підсумки уроку.
ІIV. Домашнє завдання. §17, завдання 2 ст.89.
Урок №9
ТЕМА: Хімічні властивості середніх солей.
МЕТА: розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі властивостей середніх солей;
розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей;
виховувати у школярів зацікавленість до предмета через яскраві досліди
ТИП УРОКУ: комбінований
ФОРМИ РОБОТИ: розповідь учителя, експеримент, дидактичні ігри.
ОБЛАДНАННЯ: Періодична система хімічних елементів Д.І.Менделєєва,
розчини реактивів, роздатковий матеріал.
СТРУКТУРА ТА ЗМІСТ УРОКУ
Працюючи від душі , ви зробите все і для близьких,
І для себе, а якщо успіху не буде , працюйте ще.
Д.І.Менделєєв
 І.ОРГАНІЗАЦІЙНИЙ ЕТАП
І.ОРГАНІЗАЦІЙНИЙ ЕТАП
Сьогодні у нас , учні, урок незвичайний.
І вчитель ваш є , і багато гостей:
Та прошу вас , шановні, в процесі навчання ,
Уважними бути урок увесь цей
( метод кольоропису )
Із наявних кольорів вчитель пропонує учням підняти той, який відповідає їх настрою перед уроком: ( СЛАЙД 1)
Червоний - радість, захоплення.
Оранжевий-хороший настрій.
Жовтий-спокій.
Зелений - невизначення.
Блакитний-схвильованість.
Фіолетовий-агресивність.
Чорний – погане самопочуття.
ІІ.МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ.
 « Чорна скринька»
« Чорна скринька»
Вчитель описує речовину, що знаходиться в скриньці: у цій коробці знаходиться надзвичайна речовина. Колись, у східних країнах, її вважали милістю Божою, символом миру. Але, з іншого боку, скільки всього живого загубила ця речовина. Через неї навіть море може стати мертвим. Особисто я схиляю голову над цією речовиною — без неї неможливо обійтися в металургії, вона використовується у виготовленні кераміки, шкіряного взуття. За нею козаки їздили до Криму . ( СІЛЬ)
Після відповідей учнів вчитель демонструє різні види солей.
ІІІ.ВИЗНАЧЕННЯ ТЕМИ ТА ЗАВДАНЬ УРОКУ.(СЛАЙД 2)
Тема уроку: Хімічні властивості середніх солей.
Завдання: -- визначити, з якими речовинами можуть взаємодіяти солі;
-
 продовжити вчитись правильно писати рівняння реакцій та
продовжити вчитись правильно писати рівняння реакцій та
- розв’язувати задачі;
- визначити правила поведінки з солями.
.(СЛАЙД 3 )
І. Актуалізація опорних знань. ( мозковий штурм ):
- Що таке солі ?
- Які правила називання солей ?
- Як складають формули солей ?
- Як можна визначити валентність кислотного залишку?
- Як користуватися витискувальним рядом металів?
V. Основний зміст уроку:
Перед вивченням нового матеріалу учні повторюють правила техніки безпеки роботи з різними реагентами.
Праця -- найвеличніша краса.
Сухомлинський В.О.
Учні працюють в групах над виконанням « спільного проекта»(СЛАЙД 4)
 Взаємодія солей з металами.
Взаємодія солей з металами.
Лабораторний дослід.
У 2 пробірки наливаємо по 1 мл розчину купрум ( ІІ ) сульфату й обережно опускаємо в одну пробірку гранулу цинку, а в другу – залізний цвях. Що спостерігається ? Напишіть рівняння реакцій .
Zn+CuSO4= Zn SO4+Cu
Fe+ CuSO4= Fe SO4+ Fe
Взаємодія відбувається лише з тими, які у ряду Бекетова розташовані лівіше від того метала, який входить до складу солі. Метали К, Nа, Са, Ва не можна брати, бо вони реагують з водою.
- Взаємодія солей з лугами.
Лабораторний дослід.
У пробірку наливаємо 1 мл розчину купрум ( ІІ ) сульфату і додаємо стільки ж розчину натрій гідроксиду. Що спостерігається ? Напишіть рівняння реакцій.
CuSO4+2NaOH=Cu(OH)2+Na2SO4
Відбувається при умові – утворення осаду.
- Взаємодія солей з кислотами.
Лабораторний дослід.
У суху пробірку насипаємо натрій карбонат і додаємо розчин хлоридної кислоти. Що спостерігається ? Напишіть рівняння реакцій.
Na2CO3+2HCl=2 NaCl+ CO2+H2O
Умови таких реакцій :
--утворення осаду;
-- утвореня газу.
- Взаємодія солей з солями :
Лабораторний дослід.
У пробірку наливаємо 1 мл розчину натрій хлориду і додаємо декілька краплин аргентум нітрату. Що спостерігається ? Напишіть рівняння реакцій.
NaCl+AgNO3=AgCl+ NaNO3
 --утворення осаду;
--утворення осаду;
Після проведення експерименту із кожної групи виходить один учень та записує результати проведеної роботи у таблицю, створюючи
« спільний проект»
|
Назва досліду |
Рівняння реакцій |
Спостереження |
|
Взаємодія солей з металами |
Zn+CuSO4= ZnSO4+Cu Fe+ CuSO4= FeSO4+ Fe
|
Утворення шару міді та заліза |
|
Взаємодія солей з лугами |
CuSO4+2NaOH=Cu(OH)2+Na2SO4
|
Утворення осаду |
|
Взаємодія солей з кислотами |
Na2CO3+2HCl=2 NaCl+ CO2+H2O
|
Утворення газу |
|
Взаємодія солей з солями |
NaCl+AgNO3=AgCl+ NaNO3
|
Утворення осаду |
ІV. Узагальнення та систематизація знань та вмінь.
*При взаємодії заліза масою 7 гр з сульфатною кислотою виділяється водень. Визначте його об’єм. (СЛАЙД 5)
ДАНО:
m ( Fe )=7гр 2Fe+3H2SO4=Fe2(SO4)3+3H2
V- ? n=7:56=0,125моль
X=0,125моль*3:2=0,1875 моль
V=0,1875 моль*22/4=4.2л
Відповідь: V=4.2 л водню.
*Дописати рівняння реакцій:
BaCl2+Na2CO3= CuO+H2O=
ZnCl2+Ba(OH)2= Al+CuSO4=
MgCO3+ HCl= AlCl3+AgNO3=
V. Рефлексія.
- Інтерактивна вправа « продовж речення»: Я сьогодні на уроці дізнався...
- Після вправи повертаємось до ---- до завдань уроку: чи ми їх визначили
до ---- кольоротерапії.
Червоний- радість, захоплення.
Оранжевий-хороший настрій.
Жовтий-спокій.
Зелений-невизначення.
Блакитний-схвильованість.
Фіолетовий-агресивність.
Чорний –погане самопочуття.
Оцінювання знань учнів
VI.Домашнє завдання: §19 , завдання 4 ст.93.
Група 1
ЗАВДАННЯ 1
Взаємодія солей з металами.
Лабораторний дослід.
У 2 пробірки наливаємо по 1 мл розчину купрум ( ІІ ) сульфату й обережно опускаємо в одну пробірку гранулу цинку, а в другу – залізний цвях. Що спостерігається? Напишіть рівняння реакцій .
ДОДАТКОВА ІНФОРМАЦІЯ.
Взаємодія відбувається лише з тими, які у ряду Бекетова розташовані лівіше від того метала, який входить до складу солі. Метали К, Nа, Са, Ва не можна брати, бо вони реагують з водою.
ЗАВДАННЯ 2.
При взаємодії заліза масою 7 гр з сульфатною кислотою виділяється водень. Визначте його об’єм.
ЗАВДАННЯ 3.
Дописати рівняння реакцій:
BaCl2+Na2CO3= CuO+H2O=
ZnCl2+Ba(OH)2= Al+CuSO4=
MgCO3+ HCl= AlCl3+AgNO3=
Група 2
ЗАВДАННЯ 1
Взаємодія солей з лугами.
Лабораторний дослід.
У пробірку наливаємо 1 мл розчину купрум ( ІІ ) сульфату і додаємо стільки ж розчину натрій гідроксиду. Що спостерігається ? Напишіть рівняння реакцій.
ДОДАТКОВА ІНФОРМАЦІЯ. Відбувається при умові – утворення осаду.
ЗАВДАННЯ 2.
При взаємодії заліза масою 7 гр з сульфатною кислотою виділяється водень. Визначте його об’єм.
ЗАВДАННЯ 3.
Дописати рівняння реакцій:
BaCl2+Na2CO3= CuO+H2O=
ZnCl2+Ba(OH)2= Al+CuSO4=
MgCO3+ HCl= AlCl3+AgNO3=
Група 3
ЗАВДАННЯ 1.
Взаємодія солей з кислотами.
Лабораторний дослід.
У суху пробірку насипаємо натрій карбонат і додаємо розчин хлоридної кислоти. Що спостерігається ? Напишіть рівняння реакцій.
ДОДАТКОВА ІНФОРМАЦІЯ.
Умови, при яких відбуваються такі реакції :
--утворення осаду;
-- утвореня газу.
ЗАВДАННЯ 2.
При взаємодії заліза масою 7 гр з сульфатною кислотою виділяється водень. Визначте його об’єм.
ЗАВДАННЯ 3.
Дописати рівняння реакцій:
BaCl2+Na2CO3= CuO+H2O=
ZnCl2+Ba(OH)2= Al+CuSO4=
MgCO3+ HCl= AlCl3+AgNO3=
Група 4
ЗАВДАННЯ 1.
Взаємодія солей з солями :
Лабораторний дослід.
У пробірку наливаємо 1 мл розчину натрій хлориду і додаємо декілька краплин аргентум нітрату. Що спостерігається ? Напишіть рівняння реакцій
ДОДАТКОВА ІНФОРМАЦІЯ.
Умови, при яких відбуваються такі реакції :
--утворення осаду;
ЗАВДАННЯ 2.
При взаємодії заліза масою 7 гр з сульфатною кислотою виділяється водень. Визначте його об’єм.
ЗАВДАННЯ 3.
Дописати рівняння реакцій:
BaCl2+Na2CO3= CuO+H2O=
ZnCl2+Ba(OH)2= Al+CuSO4=
MgCO3+ HCl= AlCl3+AgNO3=
Урок №10
Тема: Узагальнення знань про основні класи неорганічних сполук
Мета: сприяти повторенню основних понять з теми " Основні класи неорганічних сполук", сприяти формуванню навичок складати рівняння реакцій по схемі; розв’язувати розрахункові задачі;
сприяти розвитку вмінь порівнювати, аналізувати, аргументовано висловлювати свою точку зору;
сприяти вихованню почуття само - і взаємоповаги в умовах групової роботи, виховувати здоров’язберігаючі компетенції під час виконанні дослідів.
Тип уроку: узагальнення
Форми і методи: сюжетно-рольова гра, індивідуальна робота, "мозковий штурм", робота в малих групах, вправа "Про що?, Що, Як Навіщо"
Обладнання: роздатковий матеріал, таблиця елементів, набір реактивів для дослідів.
СТРУКТУРА ТА ЗМІСТ УРОКУ
Розум людський має
три ключі від усього :
знання, думку й уяву.
В.Гюго
І. Організаційна частина.
ІІ. Мотивація.
Сьогодні ми закінчуємо вивчати велику та важливу тему, наступний урок у Вас - тематична атестація. Тому, щоб краще підготуватися до контрольної робти, ми з Вами повторимо вміння складати формули, рівняння реакцій та розвязувати розрахункові задачі. І кожен зможе сьогодні досягти "вершини хімічних знань". Коли альпіністи збираються досягти гірської вершини, вони утворюють в "звязки", тому я пропоную обєднатися в групи-"звязки".( Під час утворення груп може звучати фрагмент пісні В.Висоцького "Если друг оказался вдруг...").
ІІІ. Актуалізація опорних знань.
"Перепустка в гори".
1.Що таке оксиди, кислоти, солі, основи?
2.Як класифікують оксиди, кислоти, солі, основи?
3.Що собою являє індикатор?
4. Які індикатори Вам відомі?
5.Як вони змінюють свій колір в кислоті, основі?
6.Що таке реакція заміщення, обміну, нейтралізації?
7.Що собою являють амфотерні сполуки?
ІV. Основний зміст уроку.
Вчитель. Дозвіл в гори ми отримали. І ось перша наша перешкода - "Лавина хімічних формул".
Учні виконують вправу "класифікатор". Дошка розділена на 4 графи : оксиди, кислоти,основи, солі. Вчитель зачитує формули речовин, а учні розподіляють по розділах в таблиці та коментують свій вибір.
|
Оксиди |
Кислоти |
Основи |
Солі |
Приблизний список речовин :
Ва(ОН)2 , СаО, СиО, LiOH, H2SO4, Fe2O3, CuSO4, NaCI , BaCI2 ,H2O, HCI, NaOH, AI(OH)3, H2SiO3, SiO2, Fe(OH)3.
Вчитель. "Лавину з хімічних формул" ми перемогли, але перед нами бурхлива гірська річка з " Мостом перетворень".
Ca(NO)2
↑
- Са → СаО→ Са(ОН)2 → СаSO4
↓
CaCI2
Mg(NO3)2
↑
2. Mg → Mg → Mg(OH)2 → MgCI2
↓
MgSO4
Вчитель. А ось перед нами виросли "Непролазні хащі із задач".
Кожна група отримує задачу, розв’язують їх.
1.Яку масу сульфатної кислоти необхідно взяти на нейтралізацію
80 г натрій гідроксиду
- Обчисліть масу солі, яка утворюється при взаємодіє хлоридної кислоти масою 3,65 г з калій гідроксидом!
Вчитель. Кожна висока гора має свої "Льодовики". Наш "Льодовик " - це експериментальні задачі. Перед тим як виконувати завдання, давайте повторимо правила техніки безпеки при роботі з скляними виробами та хімічними реагентами.
ПРАВИЛА!!!
1.В пробірках містяться вода і розчин калій гідроксиду. Визначте за допомогою реагентів, де знаходиться луг. Поясніть свої дії.
2. Від пробірок, в яких містяться сульфатна та хлорид на кислоти, відклеїлися етикетки. За допомогою реагентів визначте, яка кислота в пронумерованих пробірках. Поясніть свої дії.
Вчитель. Ось ми й на вершині!
V. Рефлексія.
Учні відповідають по черзі на питання :
Про що ми сьогодні говорили?
Що ми сьогодні робили?
Як ми це робили?
Для чого ми це робили?
VI . Підсумки уроку :
Учні здійснюють оцінення своїх знань, крокуючи по маршруту:
|
Прізвище |
Перепустка |
Лавина |
Міст |
Хащі |
Льодовики |
Вершина |
Всього |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В кінці уроку першій у «зв’язці» приносить маршрутний лист з оцінками.
VII. Домашнє завдання. Повторити основні поняття про оксиди, кислоти, основи, солі.
Урок №11
Тема: Контрольна робота по темі «Основні класи неорганічних сполук»
Мета : визначити рівень досягнень учнів по темі «Основні класи неорганічних сполук»;
продовжити розвивати навички та вміння писати рівняння реакцій та розв’язувати розрахункові та експериментальні задачі;
виховувати здоров’язберігаючі компетенції.
Обладнання: таблиця елементів, картки – завдання.
Тип уроку : контролю знань та вмінь
СТРУКТУРА ТА ЗМІСТ УРОКУ
І. Організаційний момент.
ІІ. Виконання письмової роботи.
Тест – контроль.
- Позначте визначення поняття кислоти:
А) бінарні сполуки, в яких один із елементів є Оксиген;
Б) складні речовини, які утворені атомом Гідрогену,що здатний заміщуватись на метал, та кислотним залишком.
В) сполуки, які складаються з атомів металу та гідроксильної групи;
Г) речовини, до складу яких входять атом металу та кислотний залишок.
( 1 бал )
- Позначте клас речовин, до яких належить сполука Са(NO3)2 :
А) основи; Б) кислоти В) оксиди; Г) солі.
( 1 бал )
- Позначте формулу кислотного оксиду:
А) CO2 Б) CaO В) CO Г)AI2O3.
( 1 бал )
- Виберіть ті хімічні властивості, які характеризують основи:
А) Взаємодіють з основними оксидами;
Б) Взаємодіють з кислотними оксидами;
В) Взаємодіють з водою;
Г) Взаємодіють з металами.
( 1 бал )
- Виберіть схему реакції нейтралізації:
А)NaCI+H2SO4=
Б)NaOH+H2SO4=
В) AgCI+NaCI=
Г)Na2O+HCI=
( 1 бал )
- Виберіть речовини, які використовуються для одержання кальцій карбонату:
А) метал і неметал; В)основа і кислотний оксид;
Б) основа й неметал; Г) метал і кислотний оксид.
( 1 бал )
- Рівняння реакцій Cu(OH)2= CuO +H2O характеризує хімічні властивості:
А) лугів; В) нерозчинних основ;
Б) основних оксидів; Г) кислотних оксидів.
( 1 бал )
- Позначте речовину, що реагує із фосфор (V) оксидом:
А) калій хлорид; В) кальцій оксид;
Б) кальцій нітрат; Г) хлоридна кислота.
( 1 бал )
- Позначте речовину, що реагує із магній оксидом:
А) калій хлорид; В) кальцій оксид;
Б) кальцій нітрат; Г) хлорид на кислота.
( 1 бал )
- Позначте продукти реакції розчинів барій нітрату й сульфатної кислоти:
А) барій хлорид В) барій сульфат
Б) барій гідроксид Г) барій оксид.
( 1 бал ) 3
- Установіть відповідність між формулами речовин та їх назвами:
Назва речовини формула
- Алюміній оксид А.AICI3
- Алюміній гідроксид Б.AI2O3
- Алюміній нітрат В.AI(OH)3
- Алюміній хлорид Г.AIPO4
Д.AI(NO3)3
(0-1-2-3-4 бали)
- Установіть відповідність між реагентами та продуктами реакції:
Реагенти Продукти реакції
1.Ва+Н2О= А.Барій гідроксид + водень
2.Ва+СІ2= Б. Барій гідроксид
3.ВаО+Н2О= В. Барій хлорид
4.ВаО+НСІ= Г. Барій хлорид + вода
(0-1-2-3-4 бали)
- Установіть генетичний ланцюжок одержання арґентум хлориду:
А) натрій гідроксид; Б)натрій; В) натрій хлорид.
(0-1-2 бали).
- Розташуйте газуваті речовини в ряд за збільшенням відносної густини за повітрям:
А)СО; Б)СО2; В)N20 ; Г)NO.
(0-1-2 бали).
- Розмістіть формули сполук відповідного до поданої схеми: кислотний оксид(1)→ кислота (2) → сіль(3) → основний оксид(4)
А) CuO; Б) Cu(NO3)2; В) HNO3 ; Г) NO2.
(0-1-2 бали).
- Укажіть загальну суму коефіцієнтів у рівнянні реакції взаємодії алюміній оксиду із сульфатною кислотою.( 0 або 2 бали ).
- Обчисліть масу зразка кальцій хлориду кількістю речовини 0,6 моль.
( 0 або 2 бали )
- Яка кількість речовини сірки витратиться на одержання сульфур (ІV) оксиду об’ємом 67,2 л?
( 0 або 2 бали )
Орієнтовна шкала переведення балі за тест в оцінку :
|
Бали за тест |
Оцінка |
Рівень |
|
1-3 |
1 |
початковий |
|
4-5 |
2 |
початковий |
|
6-8 |
3 |
початковий |
|
9-10 |
4 |
середній |
|
11-13 |
5 |
середній |
|
14-15 |
6 |
середній |
|
16-18 |
7 |
достатній |
|
19-20 |
8 |
достатній |
|
21-23 |
9 |
достатній |
|
24-25 |
10 |
високий |
|
26-28 |
11 |
високий |
|
29-30 |
12 |
високий |
Хімічний
Колобок
Мета: сприяти розвитку інтересу учнів початкової школи до однієї з
природничих наук-хімії;
виховувати спостережливість, кмітливість та колективізм.
Хімія
Добрий день, дорогі друзі! Ми починаємо нашу першу зустріч із королевою всіх природничих наук і суспільного виробництва - ХІМІЄЮ.
Хімія – це природнича наука, яка вміє творити дива. І як кожна наука вона вимагає до себе серйозного, відповідального ставлення .
А зараз запрошую я вас у світ казки та не простої, а хімічної.
Хімія. В деякому царстві жили собі дід та баба . Якось захотів дід колобка, але не простенького, а хімічненького.
Дід . Бабусю, піди у хижку та назмітай у засіці борошна та спечи мені колобка .
Хімія. Баба так і зробила. Спекла колобка і залишила на вікні, щоб вистиг. А колобок був не простенький, а хімічненький, тому він з вікна на призьбу, а з призьби та на землю й покотився дорогою.
Колобок. Я-хімічний колобок !Скок.Скок!/ 2 рази.
Хімія. Скаче, скаче по дорозі, а назустріч йому Зайчик –побігайчик.
 Зайчик. Колобок, колобок.
Зайчик. Колобок, колобок.
Ну й спека сьогодні.
Я захотів не простої води,
газовану щоб приніс ти сюди.
Із сиропом газовану я полюбляю –
так від спеки чогось знемагаю.
Не біга ніде тут корова яка,
Колобок, так забажалось мені молока!
Колобок. Що, зайчику, пити захотів, як всі.
Ось бачиш, колба у мене в руці
Хлюпоче в ній чарівна рідина ,
Хімічні дива нам покаже вона.
Ось сиропна вода, ось газована вона ,
Ось парне молоко, сталося це дуже легко ,
І таємниць ніяких тут нема (дослід 1).
У хімії чудес без меж, їх робити я вмію теж !
Хімія. Та й покотився !
Колобок. Я-хімічний колобок. Скок, скок.!\ 2 рази
Хімія. Скаче, скаче, а на зустріч йому Вовк :
Вовк. Колобок, колобок, прошу допомоги,
запалити багаття я невзмозі .
 Колобок. Я зараз тобі одне диво зроблю ,
Колобок. Я зараз тобі одне диво зроблю ,
без нічого полум’я вмить запалю.
Ось дрова та вату в спирт намочить ,
лиш падає крапля – багаття горить.(дослід 2).
Колобок. Секретів немає, це суміш хімічна зробила
Наш дослід таким динамічним.
Будь –що запалити зуміє вона,
Ім’я її - суміш запалювальна.
У хімії чудес без меж,
я робити умію їх теж!
Хімія . Та й побіг.
Колобок. Я -хімічний колобок .Скок, скок .\ 2 рази.
Хімія. Зустрічається йому Ведмідь:
Ведмідь. Ой, болить мені лапа, десь її я подряпав,
Колобок, прийди мені на допомогу ,
 бо можуть відрізати руку й ногу.
бо можуть відрізати руку й ногу.
Втрачати кінцівки немає бажання ,
Колобок, дай мені лікування .
Колобок.Операція без болю, правда, буде там багато крові,
Під час кожної операції потрібна стерилізація.
Розтин-це дуже важливий момент,
будь ласка, іод подайте, асистент .
Колобок. Іодом старанно змащу,
щоб все було стерильно.
Ведмеде, спокійно .
Дайте мені ніж (дослід 3 ).
Погляньте, кров тече струмком
та зараз промокнем бинтом .
Немає ані сліду від рани .
Все було чесно, без обману.
У хімії чудес без меж,
їх робити я вмію теж .
Хімія. Та й маху. Біжить та й біжить .
Колобок. Скок, скок. Я –хімічний колобок !/ 2 рази .
Хімія. Аж тут перетнула йому дорогу Лисичка:
Лисичка. Чула я, мій дорогенький, що чарівник ти, кругленький.
Так, я хочу, щоб на столі вулкан прокинувся в імлі,
Щоб попіл, полум’я, а за мить –він сам себе міг загасить .
А ще я б хотіла побачити диво:
із іскор щоб дощ накрапав так грайливо.
Колобок . Вважаю я, не тільки ти вулкан хотіла побачити .
Потрібно дослід провести, і в гори можем не іти .
 (дослід вулкан, вогні 4).
(дослід вулкан, вогні 4).
Лисичка. Де ж чудес таких навчивсь ?
Може з нами поділивсь.
Колобок. Щоб навчитись таких див ,
Докласти потрібно чимало сил,
Не лінитись, працювати
Книг багато прочитати.
Потрібно вправно,
хімію вивчати докладно.
Хімія. Я-наука не проста, і не всім під силу,
І не кожен синтезує ці хімічні дива,
Але зможе осягнути і мої закони
Лише той, хто звик долати різні перепони.
Зайчик. Хімію любіть, вивчайте та поважайте, як матінку свою,
Бо без неї не їсти і не спати, не вмитись і не одягтись,
Вовк. Не їздить і не покататись, це треба добре пам’ятать,
Ведмідь. Бо все, куди не подивись в житті,
Без хімії, як без мами, ніяк не обійтись.
Лисичка. Ніде вам не пройти без формул і рівнянь,
І без завдань та міцних хімічних знань.
Хімія. А ви, друзі, пам’ятайте
Від науки не тікайте.
Бо в хімії чудес без меж.
Ти їх зробити зможеш теж!
Всі разом. Дякуємо за увагу.
Опис дослідів:
1.У 3 завчасно приготовлені склянки з кристалами метилоранжу , розчинами соди та барій хлориду додаємо розчин сульфатної кислоти :
--- метилоранж змінює свій колір на червоний – «сиропна вода».
---ВаCl2+H2SO4=BaSO4+2HCl добування “молока» з води.
---Na2CO3+H2SO4=Na2SO4+CO2+H2O добування «газованої» води.
2.Декілька кристалів калій перманганату KMnO4 змішайте з 5-6 краплями концентрованої сульфатної кислоти Н2SO4 ,щоб вийшла кашка . Потім на цю суміш капнути етанолом С2Н5ОН .Багаття відразуж спалахне й горітиме блідо-блакитним полум’ям .
3.Спочатку змочіть руку «спиртом» ( насправді це буде розчин калій тіоціанату). Потім продезінфікуйте « скальпель», не жаліючи «йоду»,у ролі якого виступає розчин ферум (ІІІ) хлориду FeCl3. Після цього зробіть «надріз» .Проведіть «скальпелем» по ділянці шкіри ,обробленій «спиртом» -«потече кров». Потім слід загоїти «рану». Для цього візьміть розчин натрій фториду NaF й змажте ним «рану».
.4.Оранжево-червоні кристали амоній дихромату (NH4)2Cr2O7 розмістити на металевій підставці у вигляді вулкану ,промочити етанолом та запалити . Спостерігається активне виділення розжарених частинок, купка кристалів збільшується та змінює колір : замість оранжевого він стає зелений.
БІБЛІОГРАФІЯ
1. «Хімія 7-11 класи. Програми для загальноосвітніх навчальних закладів» (К. Ірпінь. ВТФ «Перун» 2005р.).
2. Підручник О.Г. Ярошенко. Хімія. (К."Освіта",2008р.).
3. Педагогічна академія пані Софії. Урок №3. (Х. «Основа», 2006 р.),ст.23-25
4. Педагогічна академія пані Софії. Урок №4. (Х. «Основа», 2006 р.),ст.5-10
5. Педагогічна академія пані Софії. Урок №18. (Х.«Основа», 2010 р.),ст. 2-14
6. Завуч. Усе для роботи. №3-4 (Х. «Основа», 2013 р.), ст.7-10.
7. Хімія.№17, ( Х. «Основа», 2012 р.), ст.23-25.
8. Хімія.№18, (Х. «Основа», 2011 р.), ст.23-25.
9. Хімія.№22, (Х. «Основа», 2012 р.), ст.6-8.
10. Хімія.№13-14, (Х. «Основа», 2011 р.), ст.32-36.
11. Хімія.№11-12, (Х. «Основа», 2011 р.), ст.58-60.
12. Хімія.№20, (Х. «Основа», 2011 р.), ст.17-20.
13. Хімія.№8, (Х. «Основа», 2011 р.), ст.18-20.
.





про публікацію авторської розробки
Додати розробку
