УЗАГАЛЬНЮЮЧЕ ПОВТОРЕННЯ. РОЗВ’ЯЗУВАННЯ ЗАДАЧ ЗА ПЕРІОДИЧНОЮ СИСТЕМОЮ
РОЗВ’ЯЗУВАННЯ ЗАДАЧ ЗА ПЕРІОДИЧНОЮ СИСТЕМОЮ
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння розв’язувати задачі;
- інформаційної — відпрацювання вмінь робити висновки й узагальнення;
- соціально-трудової — вміти оперувати знаннями, розвивати гнучкість отриманих знань;
- комунікативної — вміння працювати у групі.
- Формування предметних компетентностей: узагальнити й систематизувати знання з теми, розвивати вміння і навички користування періодичною системою, складання електронних схем і формул будови атомів, встановлення взаємозв’язку положення і будови атомів хімічних елементів з їхніми властивостями; закріпити вміння розв’язування логічних і розрахункових задач з використанням періодичного закону й періодичної системи.
Обладнання: різні види періодичної системи (коротка, довга), таблиці, алгоритм характеристики елемента, картки із завданнями.
Тип уроку: УП.
Форми проведення: прийом «Хімічна естафета», «Мікрофон», робота в гетерогенних групах.
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Прийом «Мікрофон»
Учні сідають групами, заздалегідь поділеними на початку уроку. У групах учні з різним рівнем навчальних досягнень. На дошці (або проектуємо на екран) — основні поняття вивченої теми по п’ять одразу (щоб не розсіювати увагу). Учні дають визначення цим поняттям. Починаємо з першої групи, якщо виникає затримка, учні інших груп можуть допомагати у визначеннях. Слід відмітити, що існує окрема група із сильних учнів, яка слідкує за відповідями й рахує скільки правильних визначень дає та чи інша група. Ця група називається «Експерти». Кожна правильна відповідь — 1 бал.
Відповіді слід давати коротко й точно.
- Класифікація елементів;
- лужні елементи;
- галогени;
- інертні елементи;
- періодичний закон;
- періодична система;
- період;
- група;
- підгрупа;
- атом;
- протонне число;
- нуклонне число;
- будова атома;
- склад ядра атома;
- протон;
- нейтрон;
- ізотопи;
- радіус атома;
- електронна хмара;
- електронна орбіталь;
- види електронних хмар;
- спін;
- спарені, неспарені електрони;
- металічні властивості в періодах;
- металічні властивості в групах;
- неметалічні властивості в періодах;
- неметалічні властивості в групах;
- номер періоду;
- номер групи.
IV. РОБОТА В ГРУПАХ
Знову застосовуємо проектор або роздаємо картки із завданнями «Хімічної естафети». Всього п’ять завдань. Естафету організовуємо так. На виконання кожного завдання — по 5–6 хв. Учні виконують їх на окремих аркушах, які потім здають групі «Експертів». У цей час один з учнів, наприклад, першої групи виконує перше завдання на дошці. Двоє з експертів перевіряють правильність виконання завдання на аркуші, а двоє інших слухають з класом відповідь однокласника. Якщо виникає потреба, вони вносять корективи у виконання, виправляють і ставлять питання з розв’язування цього завдання, виставляють бали. Далі учень із другої групи виконує й пояснює друге завдання, з третьої — третє і т. д.
Завдання для естафети
Запишіть рівняння реакцій за схемою:
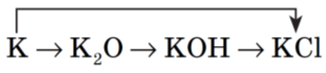
Властивості яких природних груп елементів використані в цій схемі?
Елемент розташований у ІІІ періоді, VI групі, головній підгрупі періодичної системи. Що це за елемент?
Запишіть повну будову його атома в основному та збудженому станах, укажіть кількість неспарених електронів, кількість протонів і нейтронів.
Дано елементи з протонними числами 20 і 15. Який із цих елементів має виражені металічні властивості? Чому? Запишіть формули оксидів та гідратів оксидів, що відповідають цим елементам. Укажіть їхній характер.
Елемент утворює летку сполуку з гідрогеном типу RH. Відносна молекулярна маса вищого оксиду цього елемента дорівнює 272. Який це елемент? Вкажіть кількість протонів і нейтронів у ядрі його атома.
Елемент, якому відповідає вищий оксид із загальною формулою R2O5, утворює летку сполуку з Гідрогеном, масова частка Гідрогену в якому становить 3,85 %. Що це за елемент?
V. ПІДБИТТЯ ПІДСУМКІВ ЕСТАФЕТИ
VI. ДОМАШНЄ ЗАВДАННЯ
Тренувальний варіант контрольної роботи
1. До побічної підгрупи 6-ї групи належить:
а) Арсен;
б) Молібден;
в) Ванадій.
2. У періодах зі зменшенням протонних чисел неметалічні властивості:
а) посилюються;
б) послаблюються;
в) не змінюються.
3. Вкажіть протонні числа елементів, вищі оксиди яких мають кислотні властивості:
а) 11 і 15;
б) 15 і 16;
в) 12 і 20.
4. Вкажіть протонні числа елементів, що належать до одного періоду:
а) 13 і 21;
б) 20 і 30;
в) 30 і 38.
5. Вкажіть число нейтронів у ядрі атома Хрому:
а) 24;
б) 52;
в) 28.
6. Вкажіть номер елемента, в якого на зовнішньому рівні 4 електрони:
а) 23;
б) 32;
в) 29.
7. Електронна формула 1s22s22p63s23p3 відповідає атому елемента:
а) Натрію;
б) Хлору;
в) Фосфору.
8. Однакову кількість електронних шарів мають елементи з протонними числами:
а) 13 і 21;
б) 21 і 31;
в) 31 і 39.
9. Які пари хімічних елементів мають найбільш подібні властивості?
а) P і As;
б) P і S;
в) V і Cr.
10. Установіть відповідність між електронною формулою елемента і його вищим оксидом.
1) 1s22s22p63s23p5 а) RO2
2) 1s22s22p1 б) R2O5
3) 1s22s22p63s23p4 в) R2O3
4) 1s22s22p2 г) RO3
д) R2O7
Задачі


про публікацію авторської розробки
Додати розробку
