Вікторина - гра "Подорож до Хімміста"
ВІКТОРИНА-ГРА
«ПОДОРОЖ ДО ХІММІСТА»
Цілі: повторити, систематизувати й узагальнити знання учнів з хімії; розвивати вміння аналізувати, швидко знаходити вірну відповідь; розвивати вміння застосовувати набуті знання в нестандартних ситуаціях; сприяти вихованню активної життєвої позиції в навчанні й житті; виховання допитливості, доброзичливості, взаємоповаги та вміння спілкуватися.
Форма роботи: інтелектуальна гра.
Вікторина-гра може проводитися у 8 – 9 класах протягом двох уроків. Для проведення гри клас поділяють на три групи (команди). Команди обирають капітанів – учнів (консультантів), які мають ґрунтовні знання з предмету. Консультанти готують свої команди до гри, якщо треба, звертаються за допомогою до вчителя. Під час гри капітан керує роботою команди.
Кожна команда обирає назву, готує емблему та складає хімічний кросворд з 15 слів.
Гру оцінює журі (учні старших класів або вчителя).
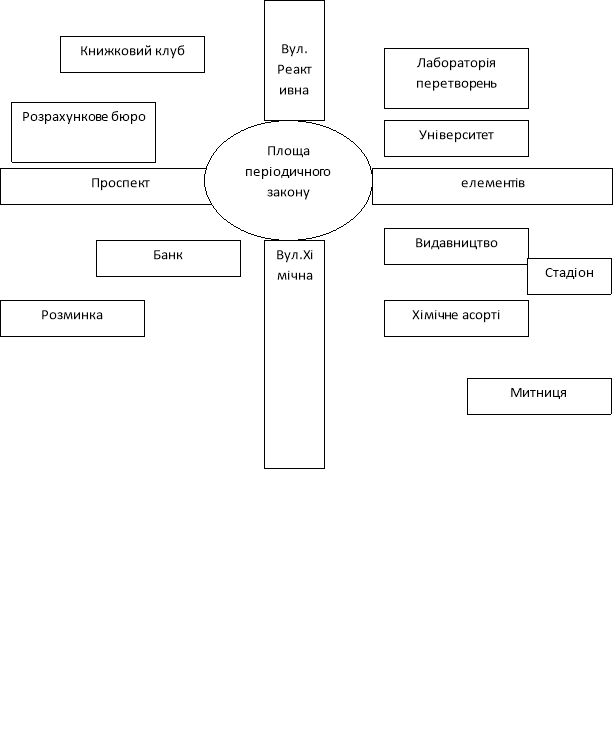
До гриуроку я завчасно готую питання та малюю план Хімміста, оформлюю маршрутні картки для кожної команди. Кабінет завчасно підготовлюється до гри: на столах розміщуються таблиці з назвами зупиночних пунктів, на дошці – три аркуша з назвами команд, на якому фіксуються результати конкурсів.
Всі команди одночасно беруть участь в конкурсах та виконують однакові завдання. Команда, яка першою виконає завдання, отримує додатковий бал.
- КОНКУРС «ПРЕЗЕНТАЦІЯ»
В цьому конкурсі оцінюється емблема – 3 бала та розповідь про назву команди – 3 бала.
- КОНКУРС «РОЗМИНКА»
Ведучий ставить питання, команди відповідають. Перемагає той, хто відповість на максимальну кількість питань за 1 хвилину. Кожна вірна відповідь оцінюється 1 балом.
Питання для команди 1.
- Сіль силікатної кислоти. (Силікати).
- Метал, рідкий за звичайних умов. (Ртуть).
- Кипіння води й конденсація водяної пари – це явище… (Фізичне).
- Закон збереження маси був відкритий ученими …(М.Ломоносов та А.Лавуаз’є).
- Залізо з домішками вуглецю – це… (Сталь).
- Речовина, яка прискорює хімічну реакцію (Каталізатор).
- Атом, який віддає електрони. (Відновник).
- Тип реакції між цинком та хлоридною кислотою. (Заміщення).
- З чого складаються фізичні тіла. (Речовина).
- Спосіб розділення суміші олії та води. (Відстоювання).
- Число, яке ставиться перед хімічною формулою в рівнянні реакції. (Коефіцієнт).
- Які основи не діють на індикатори? (Нерозчинні).
- Назвіть летку кислоту (HNO3).
- Яка сіль використовується при проведенні рентгенографії. (Сульфат барію).
- Хімічно неподільна частинка. (Атом).
Питання для команди 2.
- Формула хлоридної кислоти. (HCl).
- Будь-які зміни у світі називаються… (Явищами).
- Хімічна формула марганцівки. (KMnO4).
- Якого кольору залізо? (Сріблясто-білого).
- Як називається реакція взаємодії кислоти й основи? (Нейтралізація).
- Яка формула карбонатної кислоти? (H2CO3 ).
- Сукупність атомів з однаковим зарядом ядра. (Хімічний елемент).
- Сіль сульфатної кислоти. (H2SO4).
- Тип реакції між оксидом сірки (ІV) та водою. (Сполучення).
- Речовина, під дією якої лакмус стає синього кольору.(Луг).
- Атом, який приймає електрони. (Окисник).
- Спосіб розділення суміші води та солі. (Випарювання).
- Гідроксиди, які проявляють кислотні та основні властивості. (Амфотерні).
- Речовина, яка складається з атомів одного хімічного елемента. (Проста).
- Яка хімічна формула «їдкого натру». (NaOH).
Питання для команди 3.
- Найлегша речовина. (Водень).
- Хімічна формула інею. (Н2О).
- Якого газу найбільше у складі атмосфери Землі? (Азоту).
- Скільки частинок містить 1 моль речовини. (6,02*1023).
- Відносна молекулярна маса кисню дорівнює… (32).
- Руйнування заліза у природних умовах називають… (Корозією).
- Солі сульфітної кислоти. (Сульфіти).
- Як називають розчинні у воді основи? (Луги).
- Тип реакції між оксидом кальцію та хлоридною кислотою. (Обміну).
- Речовина, в якому лакмус стає червоним. (Кислота).
- Спосіб розділення суміші води та крейди. (Фільтрування).
- Речовина, яка складається з атомів металу та кислотного залишку. (Сіль).
- Одиниця кількості речовини. (Моль).
- Як називається горизонтальний ряд елементів у Періодичній системі? (Період).
- Хто відкрив закон об’ємних відношень. (Ж.Л.Гей-Люссак).
- КОНКУРС «РОЗРАХУНКОВЕ БЮРО»
Кожна команда розв’язує задачі. Кожна задача оцінюється в 3 бали.
Задачі для команди 1.
- Визначте молярну масу простої речовини, якщо відомо, що ця речовина кількістю 3,5моль має масу 84г.
- При розчиненні 25г солі у воді утворився розчин, знайдіть масову частку утвореного розчину.
- Визначте масу цинку для реакції з 20г сульфітної кислоти.
Задачі для команди 2.
- Обчисліть кількість речовини атомарного фосфору, що міститься у фосфор (V) оксиді масою 71г.
- У воді масою 200г розчинили сіль масо. 50г. Визначте масову частку солі в утвореному розчині.
- Визначте об’єм утвореного водню, якщо прореагувало 20г магнію з надлишком хлоридною кислоти.
Задачі для команди 3.
- Обчисліть масу речовини кальцій фосфату кількістю 0,1моль.
- Визначте масову частку солі в розчині при розчиненні 30г солі в 150г води.
- Визначте кількість речовини кальцію, яка необхідна для реакції з 20г фосфатної кислоти.
- КОНКУРС «ЛАБОРАТОРІЯ ПЕРЕТВОРЕНЬ»
Учні проводять хімічні експерименти.
Для команди 1.
Визначте речовини: хлоридна кислота, гідроксид калію, карбонат натрію, сульфат калію, фосфат калію.
Для команди 2.
Визначте речовини: гідроксид натрію, сульфатна кислота, карбонат калію, сульфат магнію, фосфат натрію.
Для команди 3.
Визначте речовини: фосфат калію, гідроксид барію, фосфатна кислота, хлорид цинку, сульфат магнію, карбонат натрію.
Максимальна кількість балів за це завдання – 9 балів.
- КОНКУРС «МУЗЕЙ»
Командам пропонують вибрати картку з цифрами від 1 до 6. Під кожною карткою скрите прізвище вченого – хіміка. Кожній команді потрібно розповісти про вченого та його досягнення.
- КОНКУРС «УНІВЕРСИТЕТ»
Треба визначити закодоване слово.
Для команди 1.
- Назвіть найпоширеніший елемент у живих організмах:
М) фосфор; Л) Карбон;
С) Оксиген; К) Гідроген.
- Який з наведених металів не реагує з карбонатною кислотою:
К) Натрій; О) Кальцій;
А) Залізо; У) Мідь.
- Як звали батька Менделєєва?
Г) Михайло; М) Іван;
Ш) Микола; В) Дмитро.
- Відносна молекулярна маса натрію:
І) 23; У) 22;
А) 16; О) 32.
- Бінарна сполука елемента з Оксигеном:
Н) Кислота; Ч) Основа;
К) Сіль; Ш) Оксид.
Слово – «СУМІШ».
Для команди 2.
- Валентність в Алюмінію:
А) 3; І)2;
О) 1; У) 4.
- Склав витискувальний ряд металів:
К) Менделєєв; П) Ломоносов;
Н) Парацельс; Т) Бекетов.
- Біле,як сніг, у пошані в усіх, подобаюсь вам, на шкоду зубам. Про що йдеться?
С) Борошно; К) Срібло;
О) Цукор; У) Молоко.
- Назвіть найпоширеніший елемент неметал на Землі:
К) Сульфур; Л)Силіцій;
М) Оксиген; П) Хлор.
- Реакцію між простою та складною речовинами називають…
К) Розкладу; А) Обміну;
С) Сполучення; І) Заміщення.
Слово- «АТОМИ».
Для команди 3.
- Метал, який надає листкам рослин зеленого забарвлення:
О) Магній; У) Купрум;
С) Натрій; Т) Алюміній.
- Хімія – наука про…
П) Тварини; Р) Рослини;
К) Речовини; У) Гриби.
- Вчений, який запропонував атомно- молекулярне вчення:
Л) Менделєєв; Н) Бекетов;
М) Прістлі; С) Ломоносов.
- Реакція між двома складними речовинами називається:
И) Обміну; О) Сполучення;
У) Розкладу; А) Заміщення.
- Відносна молекулярна маса азоту:
Д) 28; Н) 32;
П) 14; К) 40.
Слово – «ОКСИД».
Максимальна кількість балів – 5.
- КОНКУРС «ВИДАВНИЦТВО »
Кожна команда ще до гри складає кросворд. Під час гри пропонує іншій команді його відгадати. Кросворд повинен містить 15слів.
Максимальна кількість балів – 5.
- КОНКУРС «МАГАЗИН» (конкурс капітанів)
Кожен капітан обирає картки з назвами речовин (кисень, водень, хлор, азот, залізо, магній).
Завдання:описати будову речовини та її властивості.
Кількість балів – 5.
- КОНКУРС «МИТНИЦЯ»
Кожна команда повинна визначити речовини А,В, С, Д, Е.
2Ва +А = 2В
В + С = Ва(ОН)2
Ва(ОН)2 + 2Д = ВаСl2 + 2С
В + 2Д = ВаСl2 + С
ВаСl2 +Е = ВаSO4 + 2Д
Відповідь: А –О2, В – ВаО, С –Н2О, Д – НСl, Е – Н2SO4.
За кожну визначену речовину – 1бал.
- КОНКУРС «КНИЖКОВИЙ КЛУБ»
Кожна команда повинна скласти вірш, використовуя такі слова: хімія, елемент, речовина, реакція, закон.
Максимальна кількість балів – 5.
- КОНКУРС «СТАДІОН»
Кожній команді надається аркуш з недописаними формулами, які треба дописати.
Для команди 1.
Na…, Al2…, Na2…, …SO4, …(SO3)3, Ca3…, Na3…, …(PO4)2.
Для команди 2.
H…, Ba…, K3…,Mg…, …Cl, …(NO3)3, …PO4, …CO3.
Для команди 3.
Ca…, Al…, Zn3…, K…, …(NO3)2, …(CO3)3, …SO3, …Br3.
Кожна вірна формула – 0,5бала.
- КОНКУРС «БАНК»
Команди повинні вгадати загадки. За кожен вгаданий елемент команда отримує 1 бал.
Загадки:
1. Він легкий у каструлях наших,
В яких ми варимо суп чи кашу,
У літаках сріблясто-білих,
Потужних, але легкокрилих,
Він сріблястий, наче іній,
І зветься…
(Алюміній)
2. Я в усіх живих клітинах,
Я – вугілля, олівець.
Маю ще один талант:
Я блищу, бо діамант.
(Карбон)
3.Срібно-білий активний метал,
І повітря боїться не дуже.
Є у ґрунті, у наших кістках
І у водах підземних потужних.
Є він в наших зубах білосніжних,
А тому він метал дивовижний.
(Кальцій)
- Я найлегший від усіх,
Ти без мене – ані кроку.
А як з киснем я зійдусь,
То отримаєш вологу.
(Гідроген)
- Метал я- всім кажу,
Хоч і не схожий дуже,
А інша дихати допомагає.
Без мене не Землі
Життя не було б, ні.
(Оксиген)
- КОНКУРС «ХІМІЧНЕ АСОРТІ»
Кожна команда повинна вгадати елемент. За кожний вгаданий елемент - 1 бал.
Логогрифи.
- До назви якого хімічного елемента потрібно додати в кінці дві літери, щоб отримати назву корабля, який затонув, зіткнувшись із айсбергом? (Титан – Титанік).
- До назви якого хімічного елемента слід додати в кінці одну літеру, щоб отримати слово, яке означає необхідність повернення кому-небудь чого – небудь?
(Бор – Борг).
- Від назви якого хімічного елемента, викинувши три останні літери, можна утворити крик деяких птахів?
(Карбон - «Кар»).
- Від назви якого хімічного елемента, викинувши останні три літери, можна утворити назву людини, яка вміє чаклувати?
(Магній – маг).
- Від назви якого хімічного елемента, викинувши першу літеру, можна утворити назву спиртного напою?
(Хром,бром – ром)
- Від назви якого хімічного елемента,викинувши перші три літери і додавши в кінці дві літери, можна утворити назву танцю?
(Купрум – Румба)
- КОНКУРС «КВІТНИК»
Кожна команда отримує «ромашку» . На кожному пелюстку формула речовини.
Завдання для команди 1.
Написати рівняння взаємодії хлоридною кислоти з речовинами: Fe, MgO, Ca(OH)2, Zn, Fe2O3, Cu, H2SO4, CO2.
Завдання для команди 2.
Написати рівняння взаємодії гідроксиду натрію з речовинами: СO2, HCl, ZnO, CuSO4, NaHCO3, CaO, KOH, H2.
Завдання для команди 3.
Написати рівняння взаємодії сульфітної кислоти з речовинами: Ca, BaO, NaOH, CaCl2, ZnO, Cu, HCl, SO2.
Кількість балів за конкурс – 5.
Підбиття підсумків.
Нагородження переможців.
Завершальне слово вчителя.
План Хімміста


про публікацію авторської розробки
Додати розробку
