Закон збереження маси речовин під час хумучних реакцій. Схема хімічної реакції. Хімічні рівняння
Тема уроку: Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння.
Мета уроку: поглибити знання учнів про фізичні та хімічні явища; ознайомити учнів із законом збереження маси речовин у хімічних реакціях науки хімії; роз'яснити схему хімічної реакції, її суть, сформувати поняття про хімічні рівняння, пояснити правила складання рівнянь хімічних реакцій, підбору коефіцієнтів; розкрити значення закону;
вдосконалювати уміння спостерігати за ходом хімічного експерименту та робити висновки; виховувати відчуття значимості хімічних знань для повсякденного життя; формувати інтерес до предмету хімія.
Форми роботи: фронтальна робота, лабораторний експеримент, самостійна робота
Обладнання: періодична система хімічних елементів, портрет М.В.Ломоносова, пробірки, штатив, реактиви.
Хід уроку
І. Організаційний етап.
Справжнє знання – знання речей, а не слів
Монтаг’ю Мері, англійська поетеса
ІІ. Актуалізація опорних знань учнів.
Опитування:
1. Що вивчає наука хімія?
2. З чого складаються речовини?
3. Яка біологічна роль кисню?
4. Що таке явища? Які вони бувають? Які їх ознаки?
5. Наведіть приклади хімічних реакцій, які ви спостерігали у побуті?
Гра «Хто швидше?» Назвіть фізичні та хімічні явища
1. Скисання молока (х) .
2. Горіння деревини (х) .
3. Кристалізація води (ф) .
4. Танення льоду (ф)
5. Випадання роси (ф) .
6. Горіння свічки (х) .
7. Утворення інію (ф) .
8. Притягання заліза до магніту(ф).
9. Гасіння соди оцтом(х).
10. Потемніння мідного ланцюжка (х).
ІІІ. Мотивація учнів. Повідомлення теми і мети уроку
Розгадайте ребус, щоб зрозуміти, яку тему сьогоднішнього уроку ми будемо вивчати
З ,,
Всі науки базуються на законах. Що таке закон? Які ви знаєте закони? Яке їх значення? Відкрийте зошити і запишіть тему уроку.
Закон - теоретично обґрунтоване та експериментально доведене наукове твердження. Закон з’являється після пояснення та узагальнення великої кількості фактів. Його відкриття є справжньою подією в науці. Вивчення законів хімії ми розпочнемо із закону збереження маси речовин.
IV. Вивчення нового матеріалу
Історичні факти:
Відкриттю кожного закону передує велика експериментальна праця. Багато учених проводили досліди із нагріванням речовин. Одним з них був Р. Бойль. (Повідомлення учня)
- Знаменитий англійський фізик Роберт Бойль, прожарюючи у відкритій реторті різні метали та зважуючи їх до і після нагрівання, з’ясував, що маса металів збільшується. Він зробив висновок, що маса речовин у результаті хімічної реакції змінюється. Р. Бойль стверджував, що існує якась «вогняна матерія», що в разі нагрівання металу з’єднується з ним, збільшуючи його масу.
- Як і всіх хіміків, Антуана Лавуазьє цікавив процес горіння. У 1772 році Лавуазьє спільно з іншими хіміками придбав алмаз. Він помістив його в закриту посудину і нагрівав доти, поки алмаз не зник. При цьому утворився вуглекислий газ. Але маса посудини з умістом не змінилася. Продовжуючи досліди, він нагрівав у закритих посудинах метали. Обмірковуючи результати дослідів, Лавуазьє дійшов висновку, що, якщо враховувати всі речовини, які беруть участь у хімічній реакції й утворюються в результаті реакції, то жодних змін не відбувається.
- Аналогічні досліди проводив М. В. Ломоносов. Ще в 1748 році він сформулював результати своїх досліджень як закон збереження речовини — один з фундаментальних законів природи.
Саме, успіхи Лавуазьє були настільки великими й очевидними, що цей закон було прийнято всіма хіміками.
Закон збереження маси ввійшов в історію як закон Ломоносова — Лавуазьє. Його сучасне формулювання знайдіть у підручнику й запишіть до зошитів:
Загальна маса речовин, що вступили в хімічну реакцію, дорівнює загальній масі речовин, одержаних у результаті реакції.
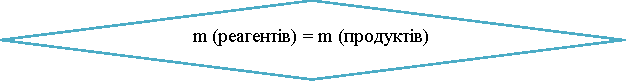
Демонстрація:
В двоколінну пробірку помістимо розчини барій хлориду й натрій сульфату. Пробірку закриваємо пробкою й підвішуємо до терезів. За допомогою важків терези переводимо у стан рівноваги. А після цього ( обов’язково із закритим аретиром) вміст двох колін пробірки змішуємо. У результаті реакції розчин стає каламутним, а після повторного зважування виявляємо, що маса пробірки з її вмістом змінилася.
СУТЬ закону:
- підтверджує, що речовини не зникають баз сліду й не утворюються з нічого;
- стверджується висновок про те, що суть хімічних реакцій полягає в перерозподілі атомів вихідних речовин й утворені нових сполук;
- завдяки йому можна складати рівняння реакцій і робити за ними розрахунки. Межі застосування цього закону – хімічні перетворення.
V. Осмислення і закріплення нового матеріалу
 ОСНОВНІ ПРАВИЛА РОЗСТАНОВКИ КОЕФІЦІЄНТІВ:
ОСНОВНІ ПРАВИЛА РОЗСТАНОВКИ КОЕФІЦІЄНТІВ:
- Коефіцієнт - це цифра, яка ставиться перед формулою речовини.
- Коефіцієнт належить всім хімічним елементам, які утворюють речовину.
- Не можна ставити коефіцієнт всередину формули відповідної речовини.
- Під час підбору коефіцієнтів перевіряють кількість атомів кожного елемента.
- Коефіцієнт 1 - не записується.
- Оксиген завжди зрівнюють останнім.
Математичне доведення закону.
Mr(Са) + 2Mr(HCl) = Mr(СаCl2) + Mr(H2)
40 + 2(36,5) = 111 + 2
113 = 113
Робота біля дошки. Розставте коефіцієнти в схемах хімічних рівнянь
а) РЬ + 02 = ? РЬО ; б) Аg + S = ?Аg2S ;
в) Н2 + F2 = ? НF ; г) Lі + 02 = ? Li20 .
 Розв’язати задачу:
Розв’язати задачу:
Під час розкладання води під дією електричного струму утворилося 0,6 г водню й 4,8 г кисню. Яка маса води, що розклалася? Дано:
m (H2) = 0,6 г
m(H2O) - ?
Виходячи із закону збереження маси речовини маємо: m(O2) = 4,8 г m(H2) + m(O2) = m(H2О), отже m(H2O) = 0,6 + 4,8 = 5,4 г
Відповідь: маса води, що розклалася 5,4 г.
Заповніть пропуски та доберіть коефіцієнти в поданих схемах:
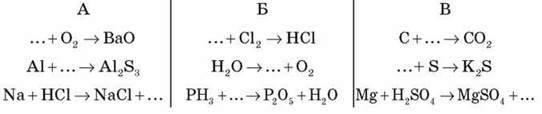
VІ. Підсумок уроку. Виставлення оцінок
Бліц-опитування:
- А хто експериментально підтвердив цей закон? (Лавуазьє, Ломоносов)
- Для чого використовуються коефіцієнти в рівнянні реакції? (Щоб зрівняти кількість атомів кожного хімічного елемента)
- То що ж таке хімічне рівняння? (Умовний запис хімічної реакції)
VIІ. Домашнє завдання.
-
 Опрацювати матеріал підручника
Опрацювати матеріал підручника
- Дайте відповіді на запитання після параграфа.
- Доберіть коефіцієнти в поданих схемах
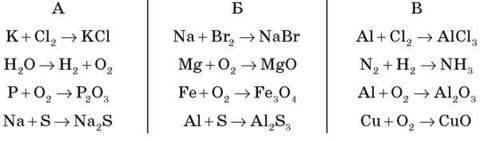


про публікацію авторської розробки
Додати розробку
