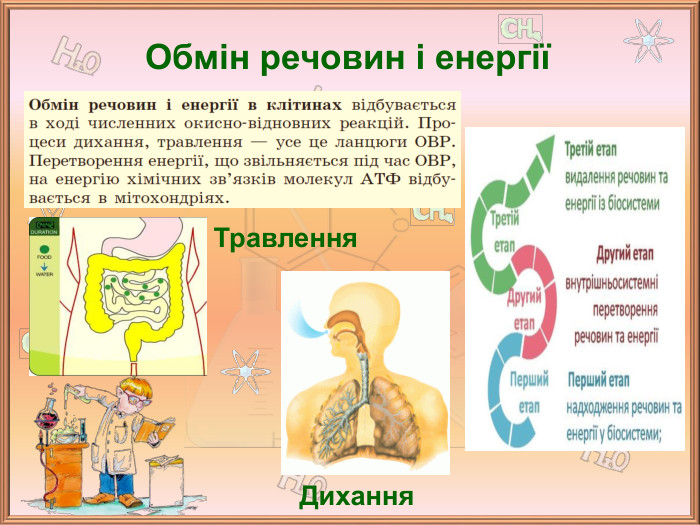
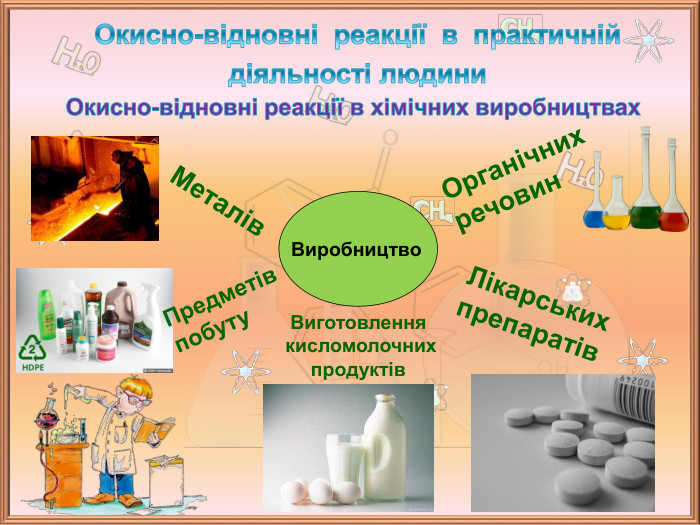
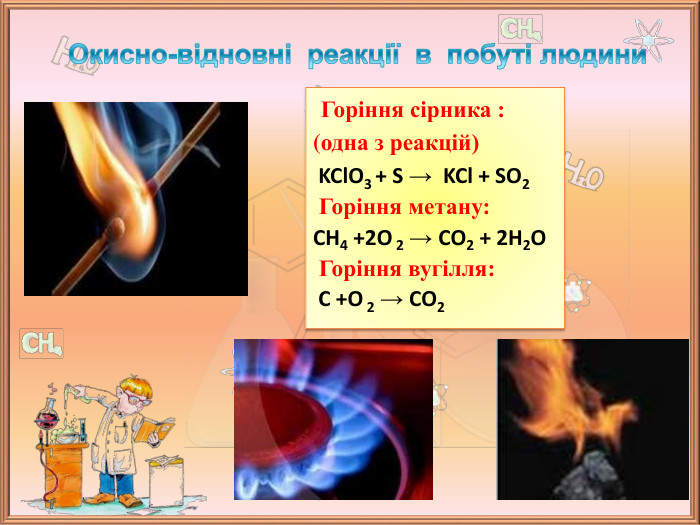
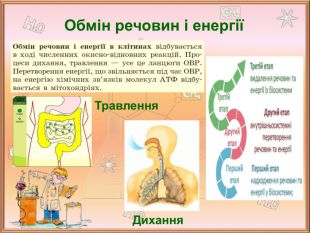
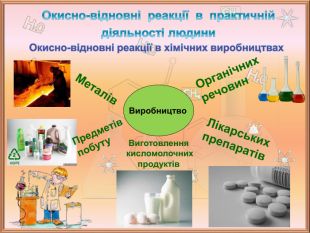
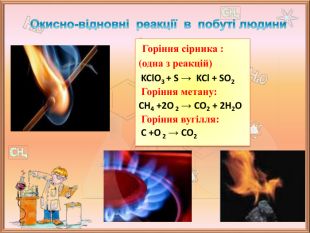
Значення окисно-відновних реакцій в природі та практичній діяльності людини
Про матеріал
Поглибити знання учнів про окисно-відновні реакції, з'ясувати значення окисно-відновних реакцій в природі та житті людини. Дізнатися про те, які окисно-відновні процеси відбуваються в природі. Зрозуміти важливість окисно-відновних процесів для існування живих організмів. З’ясувати напрямки використання окисно-відновних процесів у промисловості. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку