ДИДАКТИЧНІ МАТЕРІАЛИ. ПРАКТИЧНІ РОБОТИ З ХІМІЇ, 9 КЛАС
Для кращої роботи на уроці я в своєму досвіді використовую практичні роботи у вигляді теки для всіх класів. Хочу запропонувати вашій увазі у вигляді таблиць і цікавих завдань для загального висновку («Репортаж с места события», Задания «Отвечай – ка», «Исправляй - ка») практичні роботи для 9 класу.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ
Комунальний заклад «Петропавлівська спеціалізована школа №2 з поглибленим вивченням окремих предметів та курсів Станично-Луганського району Луганської області»
 ДИДАКТИЧНІ МАТЕРІАЛИ. ПРАКТИЧНІ РОБОТИ З ХІМІЇ, 9 КЛАС
ДИДАКТИЧНІ МАТЕРІАЛИ. ПРАКТИЧНІ РОБОТИ З ХІМІЇ, 9 КЛАС
Філіпова Анна Василівна
Вчитель хімії та біології
I категорії
11років педагогічного стажу
Для кращої роботи на уроці я в своєму досвіді використовую практичні роботи у вигляді теки для всіх класів. Хочу запропонувати вашій увазі у вигляді таблиць і цікавих завдань для загального висновку («Репортаж с места события», Задания «Отвечай – ка», «Исправляй - ка») практичні роботи для 9 класу.
Дата «___» ___________
Практическая работа №1
Приготовление раствора с определенной массовой
долей растворенного вещества
Цель: закрепить знания и навыки в решении расчетных задач; формирование умений готовить растворы с определенной массовой долей растворенного вещества; формирование практических навыков в работе с измерительными приборами.
Оборудование: химические стаканы объемом 500 мл, стеклянная палочка с резиновым наконечником, весы с разновесами, лопаточка, мерный стакан.
Реактивы: соль, вода (холодная и горячая).
Ход работы
- Расчетная часть работы.
- Задание. Приготовить __________г раствора с массовой долей вещества __________%
-
Приготовление раствора:
-
 Вычисляем массу соли и воды, которые необходимо взять для приготовления р-ра.
Вычисляем массу соли и воды, которые необходимо взять для приготовления р-ра.
- Установим весы. На обе чаши весов положим одинаковые листочки бумаги и установим равновесие. На 1-разновесы нужной массы, на 2—начинайте лопаточкой присыпать соль. Добейтесь равновесия обеих чаш. Пересыпьте взвешенную порцию соли в стакан.
- Отмерьте необходимый объем воды с помощью мерного цилиндра.
- Нальем отмеренный объем воды в стакан или колбу с солью. Содержимое перемешать.
-
- Приготовление раствора с той же концентрацией, но в горячей воде.
- Общий вывод:
«Репортаж с места события»
-
 Сегодня на уроке я узнал …
Сегодня на уроке я узнал …
- Я удивился …
- Теперь я умею …
- Я хотел бы …
Задание «Отвечай – ка»
для приготовления __________г раствора _________с массовой долей соли _______% необходимо__________________________________
- Почему растворение соли происходит лучше в горячей воде, чем в холодной?
- Почему растворение называют физико – химическим процессом?
- Какая вода закипит быстрее: морская или дистиллированная?
- Почему морская вода кипит при более высокой температуре, чем вода дистиллированная?
Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 2
«РЕАКЦИИ ОБМЕНА МЕЖДУ РАСТВОРАМИ ЭЛЕКТРОЛИТОВ»
Цель: изучить практически условия, при которых возможны реакции ионного обмена между растворами электролитов.
Оборудование: штатив с пробирками
Реактивы: растворы NaOH, HCl, CuSO4, BaCl2,Na2CO3, Na2SO3 , фенолфталеин.
Инструктаж по правилам безопасности:
- Аккуратно брать растворы в нужных количествах веществ.
- Особую осторожность проявлять при работе с растворами кислот НСl, и щелочи , NaOH.
- Бережно обращаться со стеклянной посудой.
Ход работы
|
№ |
Название опыта
|
Реактивы |
Уравнения реакции (в молекулярном, полном и сокращенном ионном виде) |
Наблюдения
|
Выводы |
|
1 |
Реакции, происходящие с образованием осадка |
а) CuSO4 и NaOH
б) CuSO4 и BaCl2
|
CuSO4 + NaOH =
CuSO4 + BaCl2
|
Образуется осадок… цвета
Образуется осадок ……. цвета |
Данные реакции протекают до конца, т.к …….. |
|
2
|
Реакции, происходящие с выделением газа |
а) Na2CO3 и HCl
б) Na2SO3 и HCl
|
Na2CO3 + HCl
Na2SO3 + HCl |
Бурное выделение газа без запаха
Выделение газа с запахом воспламеняющейся спички |
Реакции ионного обмена протекают до конца, т.к. ………… |
|
3 |
Реакции, происходящие с образованием малодиссоциирующего вещества |
NaOH, HCl, фенолфталеин. Наливаем 1мл NaOH, по каплям приливаем фенолфталеин. Далее добавляем HCl. Что наблюдали?
|
NaOH + HCl = |
|
Индикатор фенолфталеин обнаруживает, что реакция ионного обмена протекает до конца, т.к. ………….. |
Общий вывод:
«Репортаж с места события»
- Сегодня на уроке я узнал …
- Я удивился …
- Теперь я умею …
- Я хотел бы …
Задание «Отвечай-ка»
- Электролиты—это__________________________________ к ним относятся____________________________________________________
- Ионные реакции____________________________________________
- Реакции ионного обмена в растворах электролитов протекают до конца в таких случаях:_______________________________________
Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 3
Решение экспериментальных задач
Цель: научиться на практике решать экспериментальные задачи, последовательно получать неорганические вещества (нерастворимый гидроксид, оксид и т.д.), распознавать неорганические вещества по их химическим свойствам.
Оборудование и реактивы: пробирки, пробиркодержатель, сухое горючее, штатив для пробирок, спички; купрум сульфат, барий хлорид, натрий карбонат, натрий сульфит, хлоридная кислота, натрий гидроксид или калий гидроксид, индикаторы.
Ход работы
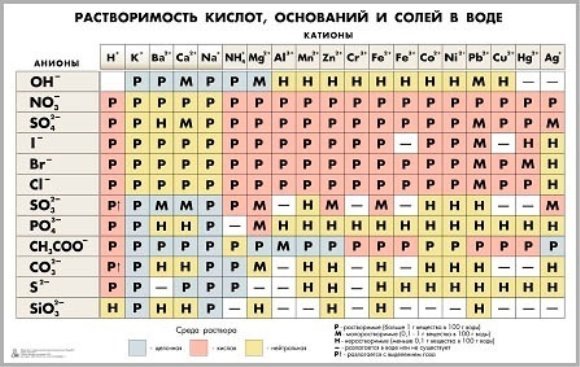
При выполнении работы пользуйтесь таблицей растворимости веществ, таблицей определением ионов.
Опыт № 1. Последовательное получение неорганических веществ.
Практически осуществить такие превращения:
купрум (2) сульфат – купрум (2) гидроксид—купрум (2) оксид – купрум хлорид.
Выполнение задания разбейте на этапы.
|
Этап |
Описание работы |
Наблюдения. Уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах, если это возможно |
Вывод |
|
1 этап. Получение нерастворимого основания: купрум (2) сульфат – купрум (2) гидроксид.
|
Чтобы из р-ра соли получить нерастворимый гидроксид, необходимо в пробирку с 0,5 мл купрум сульфата прилить 0,5мл
|
Наблюдаем …
Составляем уравнение реакции. Cu SO4 + ….. = Cu (OH) 2 + ….
|
Мы получили нерастворимый гидроксид с помощью…. вещества |
|
2 этап. Получение оксида из нерастворимого купрум (2) гидроксида, купрум (2) оксид |
Вспомните химические свойства нерастворимых гидроксидов. Напишите, при каких условиях можно получить оксид из нерастворимого гидроксида… |
Наблюдаем …
Составляем уравнение реакции в молекулярной форме… |
Мы воспользовались для получения оксида…. химическим свойством |
|
3 этап. А) Получение соли из оксида металлического элемента |
Чтобы из оксида металлического элемента получить соль, необходимо в пробирку, где находится купрум оксид, прилить 0,5 мл…. |
Наблюдаем…
Составляем уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах… |
Мы использовали для получения соли …химическое свойство оксидов металлических элементов. |
|
Б) Распознавание неорганических веществ по их химическим свойствам |
В двух пробирках с № 1 и № 2 содержатся одинаковые по внешним признакам растворы: алюминий хлорид и барий хлорид. Из каждой пробирки отлейте раствор объемом по 0,5 мл в пустые пробирки и определите, где какое вещество. Для этого прилейте необходимый химический реактив в каждую из пробирок. |
Наблюдаем в пробирке № 1… Использовали реактив… Составляем уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах…
Наблюдаем в пробирке № 2… Использовали реактив… Составляем уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах…
|
В пробирке № 1 находится…, потому что …
В пробирке № 2 находится…, Потому что… |
Общий вывод:
«Репортаж с места события»
- Сегодня на уроке я узнал …
- Я удивился …
- Теперь я умею …
- Я хотел бы …
Дополнительное задание - экспериментальная задача.
Выдано раствор соли феррум (3) хлорида. Докажите экспериментально, что в состав соли входят катионы феррума и анионы хлора. Напишите уравнения реакции в ионных формах.
Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 4
Свойства уксусной кислоты
Цель: изучить и экспериментально подтвердить свойства уксусной кислоты
Реактивы: стружка или порошок магния или цинка, кристаллический натрий карбонат (сода), растворы: уксусная кислота, феррум (3) хлорид, индикаторы, натрий гидроксид.
Оборудование: пробирки, штатив для пробирок, ложка для сухого вещества.
 Внимание!
Внимание!

Ход работы
|
Опыт № |
Описание |
Наблюдение. Уравнение реакции |
Вывод |
|
1. Действие уксусной кислоты на индикаторы |
К раствору в пробирке уксусной кислоты добавьте по каплям индикатор (метиловый оранжевый или лакмус) |
Наблюдаем…
Уравнение диссоциации:
|
Объясните свои наблюдения |
|
В пустую пробирку прилейте 0.5 мл разбавленного раствора натрий гидроксида и по каплям добавьте раствор фенолфталеина. После чего в эту же пробирку добавьте по каплям раствор уксусной кислоты до обесцвечивания раствора фенолфталеина. |
Наблюдаем…
Составьте уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах…
|
Результаты опыта свидетельствуют о том, что… |
|
В пустую пробирку налейте 0,5 мл раствора уксусной кислоты и опустите на кончике ложки для сухого вещества стружку металла. Внимание! Вещество может вспениться!!! |
Наблюдаем…
Составьте уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах…
|
Результаты опыта свидетельствуют о том, что… |
|
В пустую пробирку внесите 0,5 г кристаллического натрий карбоната и влейте 1 мл раствора уксусной кислоты. Внимание! Вещество может вспениться!!! |
Наблюдаем…
Составьте уравнение реакции в молекулярной, полной ионной и сокращенной ионной формах…
|
Результаты опыта свидетельствуют о том, что… |
Общий вывод:
«Репортаж с места события»
- Сегодня на уроке я узнал …
- Я удивился …
- Теперь я умею …
- Я хотел бы …
Задание «Отвечай – ка»
1. Какие свойства неорганических кислот имеет уксусная кислота?
2. Какие из карбоновых кислот вы используете в нашей жизни. Их физиологическое действие на организм.
Задание «Исправляй - ка»
Исправьте ошибки и расставьте коэффициенты
![]()
![]()
![]()
![]()

![]()
Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 5
Решение экспериментальных задач по органической химии
Цель: закрепить знания об органических соединениях и научиться экспериментально подтверждать и определять вещества с помощью качественных реакций.
Оборудование: штатив с пробирками, сухое горючее, химический стакан, стеклянная палочка.
Реактивы: раствор йодной настойки, лакмус, купрум (11) сульфат, раствор щелочи, крахмал, уксусная кислота, глицерин, яичный белок.
Ход работы
|
Распознаваемые вещества |
Используемые реактивы |
Наблюдения |
№ Пробирки |
|
Крахмал |
|
|
|
|
Уксусная кислота |
|
|
|
|
Глицерин |
|
|
|
|
Белки |
|
|
|
Уравнения реакций:
- Определение крахмала____________________________
- Определение глицерина___________________________
- Определение уксусной кислоты_____________________
- Определение белка________________________________
- Определение натрий ацетата________________________
Общий вывод:
«Репортаж с места события»
- Сегодня на уроке я узнал …
- Я удивился …
- Теперь я умею …
- Я хотел бы …
Задание «Отвечай – ка». Задание – экспериментальная задача:
Докажите экспериментально, что :
А) картофель и белый хлеб содержат крахмал;
Б) спелое яблоко содержит глюкозу.
Составьте перечень реактивов и оборудования, которые вам будут нужны для проведения, план действий по опытам.
1


про публікацію авторської розробки
Додати розробку
