Дополнительный материал к уроку "Щелочные металлы"
Щелочные металлы
Щелочные металлы относятся к числу наиболее активных в химическом отношении металлов. Вследствие очень лёгкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к распространённым элементам, содержание каждого из них в земной коре равно приблизительно 2%(масс). Оба металла входят в состав различных минералов и горных пород силикатного типа. Значительно меньше, чем натрий и калий, распространены литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Рубидий и цезий содержатся в небольших количествах в некоторых литиевых соединениях. Все известные изотопы Франция радиоактивны и быстро распадаются. Они получили своё названия от названия своих гидроксидов. Щелочные металлы и их соединения широко используются в технике. Наиболее практическое значение имеют натрий и калий, и их соединения.
ЛИТИЙ
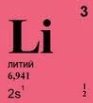

В 1817 году шведский химик Иоган Арфведсон, ученик знаменитого Йенса Берцелиуса, обнаружил в минерале петалите присутствие «огнепостоянной щелочи до сих пор неизвестной природы». Присутствие этого элемента затем было обнаружено и в некоторых минералах, входящих в состав твердых каменистых пород. Берцелиус предложил назвать её литионом как первую щелочь, найденную в царстве минералов - "камней" (по-гречески камень - λιτοσ = lithos). Это слегка трансформированное название для элемента №3 - литий - сохранилось до наших дней. В свободном виде литий получен немецким химиком Р. Бунаеном и независимо от него английским физиком О. Матиссеном через 38 лет после открытия этого элемента. Литий – серебристо-белый, чрезвычайно легкий металл. По своей легкости литий занимает первое место среди других металлов. Он в пять раз легче алюминия и почти в 2 раза легче воды. Поэтому литий плавает не только на воде, но даже и на керосине. Самолет, сделанный из лития, могли бы легко поднять … два человека! Однако из лития невозможно сделать не только самолет, но даже чайную ложку. Дело в том, что литий энергично соединяется с воздухом и водой, образуя вещества, совершенно лишенные механической прочности. Чайная ложка из лития при первом же помешивании горячего чая исчезла бы в нем без остатка. Причем «растворение» ложки сопровождалось бы бурным выделением водорода, который вытесняется литием из воды. В природе лития сравнительно много, на его долю приходится 0,02% от общего количества атомов земной коры. Крупнейшие месторождения литиевых соединений находятся в Канаде, США, в Юго-Западной Африке. В СССР месторождения литиевых минералов находятся в Казахстане, Средней Азии. Сравнительно недавно было обнаружено наличие растворимых соединений лития в насыщенных растворах соляных озер. Так, например, в толще соляных отложений озера Серс в Калифорнии были обнаружены пустоты, заполненные насыщенным рассолом, содержащим до 0,02% соединений лития (хлористый литий). Растворимые соединения лития встречаются в некоторых источниках. Из них наибольшую известность получили источники курорта Виши и Дюркгейма. Среди редких элементов литий - один из важнейших по значимости в современной силикатной промышленности, металлургии, органическом синтезе, оптоэлектронике, ядерной энергетике и др. В частности изотоп 6Li служит промышленным источником для производства трития, а изотоп 7Li используется как теплоноситель в урановых реакторах. Используется литий и его соединения и в качестве топлива для ракет Смазки, содержащие соединения лития, сохраняют свои свойства при температурах от -60 до +1500С Литий применяется в металлургии. Ничтожные добавки его (до 0,005%) к меди улучшают ее качество. Литий благодаря своей химической активности взаимодействует с кислородом, азотом, серой, растворенными в меди, и, связывая их, играет для последней роль дегазатора. Незначительные добавки лития к алюминию, магнию и другим металлам повышают прочность и делают более стойкими против действия кислот и щелочей. В парах лития можно осуществлять сварку алюминия.
Находят применение и соединения лития. Из них особого внимания заслуживает соединение лития с водородом – гидрид лития, играющий роль своеобразного материала для получения водорода. Стоит только подействовать водой на это соединение, как начинается выделение водорода. Из одного килограмма гидрида лития можно получить 2800 л водорода. Таким образом из двух килограммов гидрида лития получается почти столько же водорода, сколько его содержит стальной баллон весом в 80 кг, в котором водород находится под давлением в 120 – 150 атмосфер. Поэтому гидрид лития можно рассматривать как удобную «компактную упаковку» водорода. Главная область применения гидрида лития – термоядерные процессы.
Гидроксид лития входит в состав электролита щелочных аккумуляторов, благодаря чему возрастает срок их службы. Соединения лития применяются в керамике для приготовления глазурей и эмалей, в стеклоделии – для производства «опаловых» стекол и фильтров, пропускающих ультрафиолетовые лучи. Добавка едкого лития в щелочные аккумуляторы значительно повышает их электроемкость. Некоторые соединения лития (углекислый литий, салициловокислый литий) применяются в медицине для растворения мочевой кислоты. Накопление ее является причиной подагры. Даже в произведении Некрасова «Кому на Руси жить хорошо» бывший господский слуга с гордостью рассказывал о подагре путникам, ищущим счастливого человека на Руси.
«… Болезнью благородною,
Какая только водится
У первых лиц в империи ,
Я болен, мужичье !
По-да-грой именуется!
Одной из сложных технических задач в практике плавания на подводных лодках является очистка воздуха от углекислоты при помощи соединений лития. Решение этой проблемы было важно для космонавтов, оповестивших мир о новой победе человеческого разума. Тем не менее в бытовой практике обывателя он получил шанс стать потенциально известным лишь в последние годы - с внедрением компактных литиевых батареек для электронных часов, калькуляторов
Литий встречается в солях, входящих в состав растительных организмов. Однако функция его в них не выяснена. Особенно много лития содержат бурые и красные морские водоросли. В наземных растениях литий в сравнительно больших количествах находится в лютике, татарнике и табаке. В животных организмах литий содержится главным образом в печени и легких.
Натрий



Английский торговец старинными вещами Бэйкер, считавший себя любителем естественных наук, умирая завещал Королевскому научному обществу свое состояние. В завещании Бэйкера было записано следующее условие: проценты с денежной суммы, хранящейся в банке, ежегодно выплачивать тому, кто прочитает в Королевском обществе доклад о каком-либо выдающемся открытии.
19 ноября 1807 г. В Лондоне Гэмфри Дэви выступил с докладом и сообщил о вещах, невероятных для того времени. Опытным путем он провел разложение «нелетучих щелочей» ( продуктов взаимодействия углекислых солей натрия и калия с гашенной известью ), приведшее «к выделению новых и необычайных тел, лежащих в основе этих нелетучих щелочей». Было установлено, что «нелетучие щелочи» представляют собой не простые вещества, как долгое время считали раньше, а сложные соединения. Под действием электрического тока эти соединения разлагаются с выделением разных, но очень похожих по химическим свойствам элементов. Один из них Дэви назвал «потассием», произведя это название от созвучного английского слова, означающего поташ. Другой Дэви назвал «содием» от латинского слова «сода».
В 1810 г. Гильберт вместо названия «потассий» ввел название «калий» (от арабского слова «алкали» - щелочь). Шведский химик Я. Берцелиус в 1811 г. Заменил «содий» названием «натрий», произведя его от арабского слова «натрон» - сода. Русский химик Г.И. Гесс ввел в 1831 г., эти названия в русскую химическую литературу.
Дэви показал слушателям открытые им металлы и продемонстрировал их химические свойства. В склянке под слоем керосина они сверкали нежным серебристым блеском, но стоило бросить их в воду, они, к большому удивлению присутствующих, не тонули в ней, а плавая, начинали быстро двигаться, «бегать» по ее поверхности, расплавляясь в блестящие капельки. Одни из них даже загорались. Вода, где происходили эти явления, превращалась в раствор, обладающий всеми свойствами крепкой щелочи. Металл, загорающийся от воды! Это было невероятно. И недаром один из присутствующих на лекции Дэви слушателей, пораженный всем виденным, сказал: «Ведь этак, пожалуй, завтра начнут чуть ли не из нюхательного табака добывать электричеством золото, алмазы или еще черт знает что!». Среди всех элементов натрий по распространенности на Земле входит в первую десятку. Он обнаружен в составе более семисот минералов, является главным металлическим элементом морской воды. В практику наших предков с глубокой древности вошли такие природные соединения натрия как каменная соль (галит - NaCl) и сода, или натрон, - Na2CO3•10H2O. Последнее упоминается в Ветхом завете в качестве моющего вещества под названием "нетер". У древних греков оно фигурировало как "нитрон", а арабские алхимики употребляли термин "натрон". Отсюда и произошло современное название "натрий".
Натрий – исключительно активный металл. Вот почему, являясь одним из распространенных элементов и составляя 2% в общем числе атомов земной коры, он не встречается в свободном состоянии. Соединения его весьма разнообразны, и некоторые из них широко распространены. К их числу относится знакомая всем поваренная соль. Соль состоит из натрия и хлора. В свободном состоянии оба эти элемента обладают губительным действием на организм животных и человека. Однако в соединении они дают соль, без которой невозможна жизнь человека и животных. Соль необходима организму для обеспечения важнейших физиологических процессов. Этим объясняется естественная потребность человека и животных в соли. В крови соль создает необходимые условия для существования красных кровяных телец, в мышцах сохраняет способность к возбудимости, в сердце определяет его ритм, в желудке образует соляную кислоту, без которой невозможно переваривание и усвоение пищи. Таково значение для организма поваренной соли. Необходимость соли для жизни была известна со времен глубочайшей древности. И не случайно значение соли нашло свое отражение в многочисленных народных пословицах, поговорках и обычаях. «Хлеб да соль» - вот одно из пожеланий, которым русские люди с давних пор приветствовали друг друга во время приема пищи, подчеркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия. Хлебом и солью русские люди издавна встречали своих дорогих гостей, любимых героев, вождей и полководцев, борцов за свободу и счастье. В год каждый человек с пищей потребляет от 8 до 10кг соли. Недаром говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается это не так уж много и по весу и по времени за год вдвоем и будет съеден пуд (16кг) соли.
Наибольшее количество натрия связано в соединении с хлором. Соль, или, как ее называют химики, хлористый натрий, образует мощные отложения.
Огромные количества соли содержат в себе воды морей и океанов. Солью, извлеченной из морских вод, можно было бы засыпать всю сушу земного шара . Так велико количество соли!
Натрий находит применение в авиамоторах для отвода тепла от клапанов. В качестве теплоносителя металлический натрий используется в некоторых атомных реакторах. В производстве искусственного каучука натрий играет роль волшебного ускорителя реакции. Натрий применяется в специальных газосветных лампах. Натриевые лампы являются мощными источниками света с высоким коэффициентом полезного действия.
С помощью натрия на расстоянии 118 тыс. км от Земли была создана искусственная комета выбрасыванием в мировое пространство натриевых паров с борта космической ракеты, впервые в истории человечества созданной руками советских людей и запущенной в просторы вселенной 2 января 1959 г. Вторая искусственная комета была создана во время полета второй космической ракеты на Луну. Выброшенное из ракеты натриевое облако достигло 600 км в диаметре за 4 мин. Свечение искусственной кометы можно было наблюдать через специальные фильтры. Оно позволило уточнить координаты ракеты и определить возможность расхождения расчетных данных с действительной траекторией.
Калий
Рассказ об этом элементе можно начать словами известного немецкого химика Юстуса Либиха: «Отдайте почве то, что вы у нее взяли, или не ждите от нее в будущем столько, сколько она давала раньше». Эти слова были сказаны более ста лет назад, однако они несколько не утратили своего значения и в наши дни. Для нормального развития всех растений в почве необходим ряд элементов. Одним из них является калий, и его отсутствие ведет к их гибели.
Агрономический акцент звучит и в стихах Веры Инбер об узбекском хлопке:
О, если бы вы знали,
Какой за ним уход!
Он принимает калий,
Ему дают азот.
Калий, на долю которого приходится 1,1% от общего числа атомов, почти никогда не образует мощных отложений. Долгое время (с 1843 г.) было известно только одно весьма значительное месторождение калийной соли – Стассфуртское в Германии, имевшее промышленное значение.
Выдающийся химик нашего времени Н.С. Курнаков, изучая совместно с геологом П.И. Преображенским соляные озера и минеральные источники СССР, открыл одно из величайших в мире месторождение калия – Соликамское.
Кроме Соликамска, месторождения калийных солей были обнаружены в Северо-Западном Казахстане, на Украине, в Станиславской и Дрогобычской областях. В последние годы были разведаны новые залежи калийных солей в Белоруссии. Одно из них – Солигорское является крупнейшим в Европе.
У Евгения Нефёдова в цикле стихотворений 2004 г., посвящённом соляным шахтам г. Солигорска , используемым как "бронхиальная лечебница", есть такие яркие строки:
Чудо-слиток в ярких искрах
На ладони я держу.
Соль земли, навеки близкой,
Теплотой твоей дышу.
Спрессовались в пласт калийный
Алый цвет и белый цвет,
Обрамляя древней глины
Малахитовый просвет…
Соединения калия были найдены также на северо-западе Польши в районе бывшей крепости Быгдош. В последнее время в Израиле делаются попытки извлечения калийных солей из воды Мертвого моря.
Роль калия не исчерпывается применением его соединений в качестве удобрения. Соединения калия – необходимая составная часть клетки каждого организма и человека. Определенное соотношение между калием и другими элементами необходимо для обеспечения нормальной работы мышц, и главное – мышцы сердца.
Свойство калия присутствовать во всех живых организмах отразил Илья Сельвинский в шуточном стихотворении об элементном составе человека:
Но вот его ценность - довольно мило:
Жира - на семь копеек мыла,
Железа - на гвоздик, тупой с обеих,
Фосфора - на три копеек спичек,
Калия - с выстрел (да и он плох),
Серы - против десятка блох.
Всего же в итоге на сорок копеек.
Калий здесь выступает как компонент селитры (KNO3) - составной части черного пороха
Соединения калия весьма многочисленны и широко применяются в различных областях практической деятельности человека. Например, без соли калия – хромпика нельзя приготовить хорошую кожу для обуви.
Калийная щелочь – едкое кали – необходимое вещество в химической, фармацевтической и других отраслях промышленности. Для специальных целей необходимо например, жидкое мыло. Его можно получить с помощью того же едкого кали. Большие количества этого вещества необходимы для железоникелевых, или, как называют их, щелочных, аккумуляторов.
Калий дает не только плодородие почве, но и тепло земному шару. Калий принадлежит к немногим «легким» элементам, один из изотопов которого обладает естественной радиоактивностью. Специалисты подсчитали, что за счет радиоактивного распада калия в земной коре выделяется большое количество тепла. Наличием в организме человека около 0,003 г. радиоактивного изотопа калия объясняется и свойственная человеческому организму радиоактивность, выражающаяся в распаде не менее 5000 атомов калия в каждую секунду.
Соединение калия с хлором и кислородом – хлорат калия, или, как чаще его называют, бертолетова соль – обязательная составная часть праздничного фейерверка. Особую и давнюю известность калий получил в форме его цианида (KCN). Из всех сильных ядов не растительного происхождения цианистый калий, пожалуй, самый популярный. Поэты. естественно, это отразили:
Имя тебе непонятное дали.
Ты - забытьё.
Или, точнее, цианистый калий -
Имя твоё.
Георгий Адамович
Борис Пастернак (стихотворение "Январь 1919 года") даже допускает поэтическую вольность, оставляя лишь половину названия и не сомневаясь в узнаваемости целого. И хотя опущен именно калий. Вот эти строки:
Вот шепчет мне [новый год. В. Б.]: "Забудь, встряхнись!"
И с солнцем в градуснике тянется
Точь-в-точь, как тот дарил стрихнин
И падал в пузырек с цианистым.
Михаил Синельников, говоря о друзьях ("Порою они предавали. // А всё же любили меня…"), пишет:
Кто жестко протянет десницу,
Кто глянет и словом спасет.
Цианистый калий в больницу,
Пожалуй, один принесет.
В свободном состоянии калий был получен в 1807 г. английским химиком Г. Дэви электролизом едкого кали. Еще арабские ученые знали щелочи. «Алкали» по-арабски – «зола», «щелочь», отсюда и название – калий, введенное в русскую химическую номенклатуру в 1881 г. Г.И. Гессом. Однако профессор Харьковского университета Гизе еще в 1813 г. до своего отъезда в Юрьев, употреблял слово «калий» для названия элемента.

В свободном виде калий – серебристо-голубоватый, легкоплавкий ( плавится при 62 С ) металл. Металлический калий очень активен. Бурно окисляется на воздухе, а от воды загорается, образуя водород и щелочь Интересен один из сплавов калия с натрием. В противоположность всем остальным сплавам натрия и калия, он при 76% калия и 24% натрия является жидким и затвердевает при – 12 С. Этот сплав применяется при синтезах органических соединений..
РУБИДИЙ
Этот металл называют темно-красным химическим недотрогой. Темно-красным он назван не потому, что имеет такой цвет. Его обнаружили в 1861 г немецкий химик Г. Бунзен и немецкий физик Г. Кирхгоф. Исследуя различные минералы, они обнаружили в спектре саксонского лепидолита две неизвестные ранее темно-красные линии. Так сигнализировал о своем появлении на свет новый элемент, который и был назван рубидием, что в переводе с латинского означает "красный". Несмотря на свое название он имеет серебристый цвет с металлическим блеском, довольно мягкий и легкоплавкий ( плавиться при температуре 390 С). А недотрогой его назвали потому, что gо химической активности рубидий в семье металлов уступает только своему "старшему брату" цезию. При соприкосновении с воздухом он самопроизвольно воспламеняется и горит розовато-фиолетовым пламенем. С водой он ведет себя еще более бурно, со взрывом, причем разлученный с кислородом водород немедленно загорается, "подливая масла в огонь". При этом рубидий совершенно не считается с физическим состоянием воды: даже замерзнув и превратившись в лед, она не перестает быть объектом нападок агрессивного металла. Подобно тому как отбойный молоток шахтера врубается в пласт угля, рубидий решительно "вгрызается" в толщу ледяных кристаллов, и только адский мороз (ниже -108 °С) способен утихомирить буяна. взрывается. Получающийся при этом гидроксид рубидия тоже старается показать характер: если ее поместить в стеклянную посуду, то от стекла вскоре останутся одни воспоминания. Да и сам рубидий при высоких температурах (300 °С и выше) быстро разрушает стекло, беззастенчиво "выпроваживая" кремний из его окислов и силикатов. Вот почему "смирительные рубашки" (ампулы) для этого металла необходимо делать из специального стекла, способного постоять за себя. Так же он ведет себя при соприкосновении с галогенами и серой. Поэтому такого недотрогу необходимо беречь от внешнего воздействия.
Как ни сложно выделить чистый рубидий из его соединений, но это только полдела: не меньше хлопот связано с его хранением. "Свежий" металл немедленно запаивают в ампулы из особого стекла, в которых создан вакуум или находится инертный газ. Иногда "камерой предварительного заключения" служат металлические сосуды, заполненные "сухим" (тщательно обезвоженным) керосином или парафиновым маслом. Только при соблюдении этих условий можно быть уверенным, что "продукт подлежит длительному хранению". Чем же вызваны столь суровые меры "наказания"?.
Рубидий - радиоактивный элемент. Испуская поток электронов, он превращается в стронций.
Высокая химическая активность рубидия обусловлена строением его атома. Как и у других щелочных металлов, на его внешней электронной оболочке находится один-единственный валентный электрон, который находится дальше от ядра, чем у лития, натрия или калия, и поэтому очень легко отходит от ядра в распоряжение других атомов.
Столь же легко рубидий расстается с электронами "по просьбе" световых лучей. Это явление, называемое фотоэффектом, присуще многим металлам, но рубидий и цезий в этом отношении вне всякой конкуренции Этот металл удивительно чувствителен к свету, под влиянием лучей которого становится источником электрического тока. С исчезновением источника света исчезает и электрический ток. Это явление в науке называют фотоэффектом, а электрический ток, который возникает при фотоэффекте – фотоэлектричеством. Это свойство рубидия дает возможность использовать его при изготовлении фотоэлементов, которые широко используются в звуковом кино, телевидении, автоматизации сложных процессов на производстве, управлении работой агрегатов и машин на расстоянии, например, в атомной технике. Хлориды, бромиды и иодиды рубидия используются в медицине как болеутоляющее и успокаивающее средство.
Другая важная сфера деятельности рубидия - органическая химия, где на долю его солей выпали обязанности катализаторов. В этом амплуа карбонат рубидия впервые выступил еще более полувека назад при получении синтетической нефти. Сегодня без него не обходится синтез метанола и высших спиртов, а также стирола и бутадиена - исходных веществ для производства синтетического каучука. Сравнительно недавно разработаны рубидиевые катализаторы для гидрогенизации, дегидрогенизации, полимеризации и еще некоторых реакций органического синтеза. Такие катализаторы позволяют вести процесс при более низких параметрах (температуре и давлении), чем в том случае, когда для этой цели используются соединения натрия или калия.
Некоторые соединения рубидия обладают полупроводниковыми свойствами, другие - пьезоэлектрическими. Как вы заметили, речь чаще идет о потенциальных возможностях рубидия, чем о конкретном использовании его в современной технике. Действительно, он не вправе пока претендовать на роль великого труженика, подобно железу, алюминию, меди, титану.
Помимо упомянутых областей применения, рубидиевые соединения в небольших количествах используются в аналитической химии - как реактивы на марганец, цирконий и благородные металлы, в медицине - в качестве снотворного и болеутоляющего средства, а также при лечении эпилепсии. В виде различных солей рубидий участвует в изготовлении специальных оптических материалов, прозрачных для инфракрасных лучей, в производстве люминесцентных ламп, телевизионных и других электроннолучевых трубок. Недавно одна из электротехнических фирм ФРГ сконструировала рубидиевую контрольно-регулирующую приставку для старинных курантов, украшающих древние башни многих европейских городов и радующих слух их жителей мелодичным боем. Но вот беда: почти все куранты страдают хроническим "заболеванием" - уж очень не точны эти громоздкие средневековые механизмы. Новая приставка - атомный эталон частоты - гарантирует курантам безупречную точность хода (до сотых долей секунды в сутки).
Еще большая точность нужна ядерной физике, лазерной технике, космической навигации: здесь погрешность измерения времени порой "не вправе" превышать миллионные доли секунды в сутки! Таким требованиям отвечают созданные в нашей стране атомные часы, "сердцем" которых служит изотоп рубидия. Принцип их действия основан на том, что атомы химических элементов способны поглощать или излучать энергию только определенной длины волны (частоты).
Для каждого элемента эта длина волны строго постоянна, поскольку она зависит лишь от строения атома. Поэтому атомные (или, как их еще называют, квантовые) часы на несколько порядков точнее, чем любые другие, в том числе и кварцевые, в которых роль маятника играют упругие колебания кварцевой пластины. Точность рубидиевых часов такова, что если бы их "завели" на рубеже новой эры, то к нашим дням они отстали бы или убежали вперед не более чем на... одну секунду.
Послужной список этого металла в ближайшее время увеличится. Да и природа не страдает от недостатка этого металла На долю рубидия приходится 0,004% от общего числа атомов земной коры. Его значительно больше в недрах земли, чем, например, хрома, цинка, никеля , меди, свинца и др. металлов. Собственных минералов этот металл не имеет, не говоря уже о крупных месторождениях. Его соединения являются постоянными спутниками соединений калия и натрия. Наиболее богаты соединениями рубидия воды отдельных минеральных источников и некоторые минералы вулканического происхождения. Довольно богаты этим элементом знаменитые одесские лиманы, но еще больше его в каспийских водах. Не обошел рубидий своим вниманием и многих представителей растительного мира. Некоторые виды растений извлекают из почвы соединения рубидия. Следы его встречаются в морских водорослях и табаке, в листьях чая и зернах кофе, в сахарном тростнике и свекле, в винограде и некоторых видах цитрусовых. А в виноградном соке его содержание колеблется от 0,5 до 1 мг в литре. Даже в крови человека есть соединения рубидия. Кстати у мужчин его содержание больше, чем у женщин.
Цезий
Цезий же приобрел печальную популярность (после трагического "чернобыльского" 1986 года) благодаря своему радиоизотопу 137Cs. Образующийся во всех атомных реакторах, он является одним из главных компонентов радиоактивного загрязнения биосферы.
Нуклиды, цезий, фон, Чернобыль…
Кружилась, никла голова.
И так нам нужно было, чтобы
Сном стали все эти слова.
В. Глущенко, 1989
Небесно-голубым называется этот металл, который мог бы плавится (28,50 С)от тепла ладони, После ртути – это самый легкоплавкий металл природы. Открыт цезий сравнительно недавно, в 1860 г., в минеральных водах известных целебных источников Шварцвальда (Баден-Баден и др.). Свое название цезий получил от двух светло-голубый линий, которые хорошо видны в его спектре .В начале 50-х годов прошлого века профессор химии Гейдельбергского университета Р. Бунзен обратил внимание на малозначительное, казалось бы, для науки явление: если в пламя газовой горелки вводили соли металлов, оно окрашивалось в разные цвета. Бунзен заинтересовался ‘этим всерьез. Он подносил к горелке крупицы различных веществ и всякий раз язычок пламени, словно хамелеон, менял свою окраску, становясь то желтым, то фиолетовым, то розовым. В этих экспериментах отчетливо выявлялись две закономерности: во-первых, каждый из "подопытных" металлов придавал пламени определенный цвет, а во-вторых, этот цвет не зависел от того, в каком виде металл "приговаривался к сожжению". Например, все соединения бария делали пламя зеленоватым, а кальций, попадая в огонь, заставлял его краснеть как бы в отместку за свои муки.
Напрашивалась мысль: нельзя ли воспользоваться подмеченными закономерностями, чтобы просто и быстро устанавливать, какие элементы присутствуют в исследуемом веществе? Такое открытие означало бы поистине революционный переворот в химическом анализе. К сожалению, заманчивую на первый взгляд идею трудно было претворить в жизнь. Дело в том, что любое вещество содержит, как правило, несколько компонентов, не говоря уже о примесях, которые обычно не желают оставаться незамеченными
Но на помощь Бунзену пришел его друг физик Кирхгоф. Он-то и сумел оживить идею Бунзена, предложив рассматривать не само пламя горелки, а его спектр, поскольку в нем все цвета и оттенки видны гораздо отчетливее. Из двух подзорных труб, стеклянных призм и ящика из-под сигар Кирхгоф соорудил спектроскоп - прибор, позволявший как бы разлагать пламя на составные части. Если раньше информация о пламени воспринималась невооруженным глазом ученого, то теперь луч света от горелки проходил через несколько линз и призму, превращаясь в красочную полоску с многочисленными вертикальными линиями. Когда Бунзен поместил в пламя кристаллик поваренной соли, Кирхгоф, смотревший в прибор, увидел на фоне черной полосы две яркие желтые линии. Были "преданы огню" другие соединения натрия - сода, селитра, сульфат натрия, но всегда в одном и том же месте спектра возникала неразлучная ярко-желтая пара. Сомнений не было: такова "визитная карточка" натрия. Другой металл "рисовал" линии другого цвета, в другом месте спектра.Ученые провели исследования с сотнями различных веществ и убедились, что каждому элементу присущи свои спектральные линии Бунзен и Кирхгоф тщательно изучили спектры всех известных тогда науке химических элементов и каждому из них дали точную спектральную характеристику. Это ознаменовало рождение нового метода анализа - спектрального. С помощью его можно не только обнаружить элемент, но и определить по интенсивности линий его количество. Однако возможности спектрального анализа этим не исчерпывались.В 1860 году, в лабораторию Бунзена пришла посылка с минеральной водой из знаменитых шварцвальдских источников. Врачи, приславшие воду, просили выяснить ее состав: им хотелось узнать, чему она обязана своими целебными свойствами. Бунзен выпарил воду, получил сгущенный раствор и внес каплю его в пламя газовой горелки. Глядя в окуляр спектроскопа, он наметанным глазом заметил линии натрия, калия, кальция, стронция, лития...Но что это за две голубые незнакомки? Стронций? Нет, он сигнализирует о себе одной линией. Снова и снова ученый рассматривает спектр и сравнивает его с известными эталонами, но среди них нет ничего похожего. В этом же убеждается и Кирхгоф. Значит, открыт новый химический элемент, а называться он будет цезием: ведь в переводе с латинского это - "небесно-голубой".Итак, цезий стал первым элементом, открытым не химическим путем, как другие химические элементы, а методом спектрального анализа..
.

Еще в 1846 году немецкий ученый К. Платтнер занялся исследованием полуцита-минерала, найденного на острове Эльба. При изучении этого минерала, произведенном до открытия спектрального анализа, неизвестный в то время цезий был принят за калий, с которым цезий имеет много общего. Но так как калий легче цезия, то нехватка при подсчете составила 7%
Цезий - один из редчайших элементов, но все же следы его можно найти во многих горных породах, в морской воде, а его "связи" с минеральной водой вам уже известны (правда, чтобы получить несколько граммов цезиевых солей, Бунзену пришлось выпарить "всего-навсего" 40 тонн целебного напитка). Небольшие количества цезия обнаружены в сахарной свекле, зернах кофе, чайных листьях. Он знаком и каждому курильщику: две голубые линии в спектре табачного пепла показывают его наличие.Если бы металлы, подобно спортсменам, могли рассчитывать на приз "За активность", то судейская коллегия из самых авторитетных химиков без колебаний присудила бы его цезию. И дело не только в том, что этот элемент занимает самое "металлическое" место в периодической системе (если не считать франция, которого практически нет в природе), но и в том, что он полностью оправдывает свое "особое положение".В чистом виде цезий чрезвычайно активный металл. На воздухе, он немедленно воспламеняется и сгорает. Попадая в компанию с серой или фосфором , с галогенами, он тут же начинает бурно "возмущаться", и это всегда приводит к взрыву. Общение цезия с водой также чревато конфликтной ситуацией, сопровождающейся взрывом и пожаром - горит выделяющийся в ходе реакции водород.
Даже лед не выдерживает нападок цезия и вступает с ним в шумную "перепалку", причем разнять их не может и лютый холод (до -116 °С) Поэтому получить его в чистом виде очень сложно.
Само собой разумеется, изготовлять из цезия детали или изделия, которые должны подвергаться механическим нагрузкам, работать в жарких условиях или находиться в контакте с химическими "агрессорами", занятие, мягко выражаясь, неблагодарное. Так, может быть, этот недотрога "голубых кровей" вообще ни на что не пригоден и представляет интерес лишь сугубо с научной точки зрения? Железу, титану, алюминию он и впрямь не конкурент, зато у него есть такие свойства, какими, кроме него, не обладает ни один металл. Большая активность цезия по отношению к воздуху ( кислороду, азоту) используется для создания вакуума при изготовлении радиоламп. Достаточно поместить кусочек цезия в колбу лампы, как остатки воздуха, которые нельзя откачать насосом, будут мгновенно поглощены цезием. Все, кто пользуется услугами метрополитена, каждый день проходят мимо фотоэлементов. Они вмонтированы в контрольные турникеты, устроенные очень просто: с одной стороны - фотоэлемент, с другой - источник света, направляющий луч на своего "визави". Как только в городе стемнеет, фотоэлемент включает фонари. Фотоэлемент умеет сортировать сигареты, подсчитывать число деталей, проплывающих мимо него на конвейере, проверять, достаточно ли хорошо отшлифована поверхность шариков для подшипников, читать запись на звуковой дорожке киноленты. Надежнее любого сторожа эти чуткие приборы охраняют ночью магазины, банки, склады.Без фотоэлементов немыслима была бы сама идея передачи изображения на сотни и тысячи километров. Если вы вчера с интересом смотрели по телевизору хоккейный матч, концерт или очередную "порцию" захватывающего многосерийного фильма, то не грех поблагодарить за это цезий: без него ваш телевизор имел бы не больше шансов на передачу изображения, чем ящик из-под макарон. С помощью фотоэлементов удалось "снять копию" обратной стороны Луны. А разве можно было бы передать по проводам чертежи, схемы, портреты, письма, если бы фототелеграфная связь не пользовалась услугами не равнодушных к свету электронов? Конечно, нет. Фотоэлектрические свойства цезия позволили создать интроскоп - прибор, позволяющий заглянуть внутрь непрозрачных тел и заметить в них возможные дефекты. Чувствительность цезия к инфракрасным лучам лежит в основе конструкции "ночезрительных труб" - так М. В. Ломоносов называл приборы, о которых он мог только мечтать. А сегодня оптический "глаз", способный видеть в темноте, помогает человеку ночью вести автомобиль, прицельно стрелять, обнаруживать различные объекты. Фотоэлектрические свойства цезия намного больше, чем у рубидия.
Но цезий готов поделиться своими электронами "по просьбе" не только света, но и тепла. Благодаря этому свойству он охотнее многих других химических элементов переходит в состояние ионизированного газа - плазмы. Цезиевая плазма представляет огромный научный и практический интерес. В космическом пространстве, например, где степень разрежения очень высока, поток электронов, выделяемых атомами цезия, способен создавать мощную реактивную тягу и придавать ракетам колоссальную скорость - по расчетам некоторых зарубежных ученых, до 44 километров в секунду! Возможно, недалек уже тот час, когда межпланетные корабли на цезиевом "топливе" будут заходить в самые далекие порты и гавани Вселенной.Цезиевая плазма широко используется и на Земле. С ее помощью магнитогидродинамические генераторы (МГД-генераторы) преобразуют тепловую энергию в электрическую. Одно из многих достоинств этих генераторов - их простота. Без цезия не обходятся и термоэмиссионные преобразователи (ТЭП), в которых тепловая энергия ядерного реактора без задержки превращается в электрический ток. Ученые различных стран проводят множество исследований, главный объект которых - цезий. Ученые из индийского Института геофизических исследований, изучившие воду 60 горячих источников в Гималаях, пришли к выводу, что высокая концентрация цезия в воде может быть признаком магматической активности недр. Повышенная концентрация радиоактивного изотопа цезия-137 обнаружена в деревьях, сохранившихся в районе знаменитого Тунгусского взрыва, причем химическая аномалия характерна как раз для тех слоев ствола, которые относятся к 1908 году, когда произошло это событие.
. В 1967 году Международная генеральная конференция по мерам и весам установила: "Секунда - время, равное 9192631770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133".
Коротко и ясно! Хотите отсчитать секунду, так это проще пареной репы: нужно только подождать, пока электрон цезия перепрыгнет с одной своей орбиты на другую указанное число раз.
Атомные часы на этом принципе уже работают и, надо сказать, неплохо: за три тысячелетия точность их хода может измениться всего на одну секунду. О цезии можно рассказывать много. О его каталитических способностях и умении создавать вакуум в радиолампах, о его изотопах, применяемых в медицине, дефектоскопии, измерительной технике, о получении с помощью этого элемента сцинтилляционных монокристаллов, способных светиться холодным голубоватым или зеленоватым светом под действием любого излучения - рентгеновского, ультрафиолетового, радиоактивного. Можно смело сказать, что областям применения цезия и перспективы его поистине безграничны!
ФРАНЦИЙ
Элемент с порядковым номером 87 был предсказан в 1870г Д.И. Менделеевым, но ещё 69 лет место в периодической системе с надписью «Экацезий» было не заполнен. Менделеев не только указал будущее "местожительство" ряда элементов, но и с большой точностью предсказал физические и химические свойства элементов. Элемент № 87 должен быть надежным хранителем щелочных "традиций", крепнущих от лития к цезию. Его высокая реакционная способность (выше, чем у цезия), поэтому он мог присутствовать в природе лишь в виде солей, обладающих большей растворимостью, чем у всех других солей щелочных металлов. Поскольку от лития к цезию падала температура плавления (от 180,5 до 28,5 °С), можно было предположить, что экацезий в обычных условиях должен подобно ртути, находиться в жидком состоянии.
Для щелочных металлов (кроме лития) характерна еще одна закономерность: чем больше массовое число элемента (т. е. чем ниже он расположен в периодической таблице), тем меньше его содержится в земной коре. Если учесть, что уже на долю цезия в природе приходится совсем немного атомов, то расположенный под ним элемент № 87 мог и вовсе оказаться редчайшим из редких. Наконец, радиоактивные "наклонности" его соседей справа (о которых упоминал в статье Менделеев) - открытых в конце XIX века радия и актиния - позволяли утверждать, что и экацезий должен обладать радиоактивностью. Открывались все новые и новые элементы, но клетка с номером 87, забронированная за экацезием, продолжало пустовать. Правда, как было в случаях других неоткрытых элементов, «заявки» об открытии элемента 87 делались неоднократно. От них даже остались названия – «виргиний», «молдавий». Ученые пытались химическими способами обнаружить этот элемент в природе, Одни ученые рассчитывали найти его в минералах щелочных металлов или в богатых ими водах минеральных источников и морей; другие предпочитали вести розыск на радиоактивных тропах, надеясь найти экацезий среди продуктов распада соседних с ним элементов.
Он же оказался радиоактивным элементом, жизнь которого длится всего двадцать минут. Если, например, в девять часов получить этот элемент массой один грамм этого элемента, то через двадцать минут его останется полграмма, а к концу рабочего дня от него останутся невесомые количества, он просто исчезнет. Непродолжительность «жизни» экацезия затрудняет изучение его свойств. Вот почему на Земле практически нет не только ощутимых запасов этого элемента, но и мизерных его следов? Впрочем, кое-что все же есть. Пользуясь законом радиоактивного распада, специалисты подсчитали, что из 5976 * 1018 тонн земного вещества на долю франция приходится... чуть больше 500 граммов. Вот почему найти в природе хотя бы крупицу этого элемента неизмеримо сложнее, чем отыскать иголку в стоге сена.. «Год рождения» экацезия – 1939; в этом году он был впервые обнаружен Маргерит Перэ - сотрудницей парижского Института радия, ученицей Марии Склодовской-Кюри.. В честь своей родины Перэ назвала его Францием.
В природе Франций также возникает, но в ничтожнейших количествах при радиоактивном распаде урана (несколько атомов на миллиард миллиардов атомов урана)
С химической точки зрения, франций - самый активный щелочной металл. Если фтор, находящийся в правом верхнем углу таблицы Менделеева, - наиболее яркий представитель неметаллов, то его антипод франций можно считать самым "металлическим" металлом.
Какую же практическую пользу может принести этот элемент? О широком применении его говорить пока рано. В настоящее время его используют для определения актиния в природных объектах А для медицины несомненный интерес представляет способность франция накапливаться в опухолевых тканях, причем (что особенно важно) даже на начальных стадиях заболевания. Благодаря этому элемент можно использовать для ранней диагностики саркомы. Такие опыты уже успешно проведены на крысах. В будущем несомненно раскроются и другие "способности" франция, а пока...
В настоящее время известно 8 изотопов Франция. Наиболее долговечным является Франций-223 с периодом полураспада в 22 минуты, а наиболее короткоживущим – изотоп с массовым числом 218 с периодом полураспада в 0,005 секунды


про публікацію авторської розробки
Додати розробку
