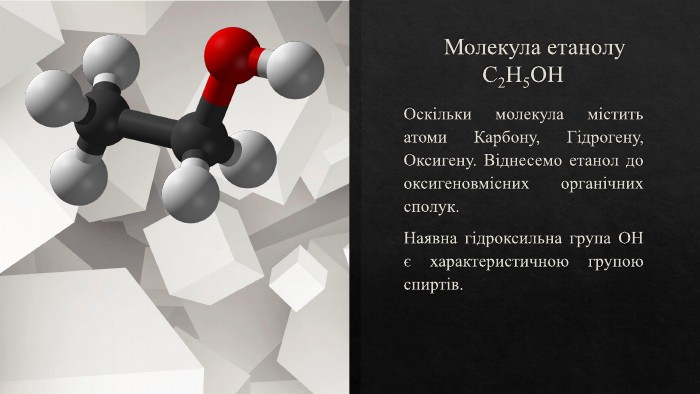
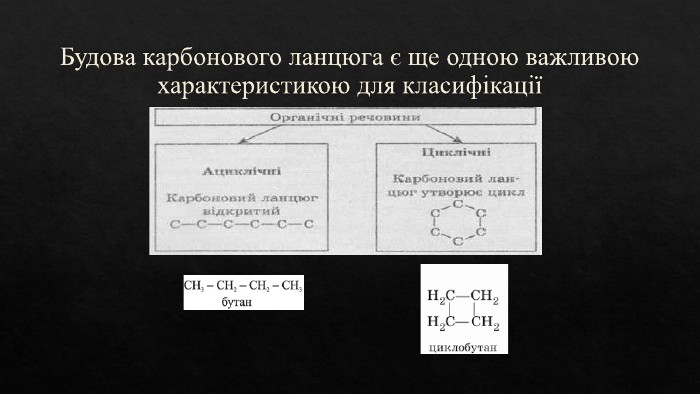
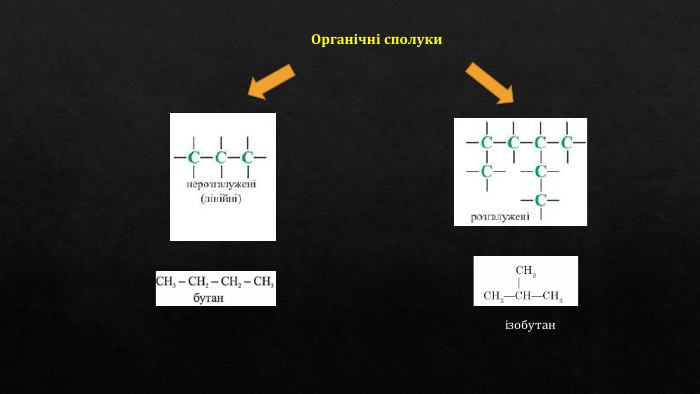
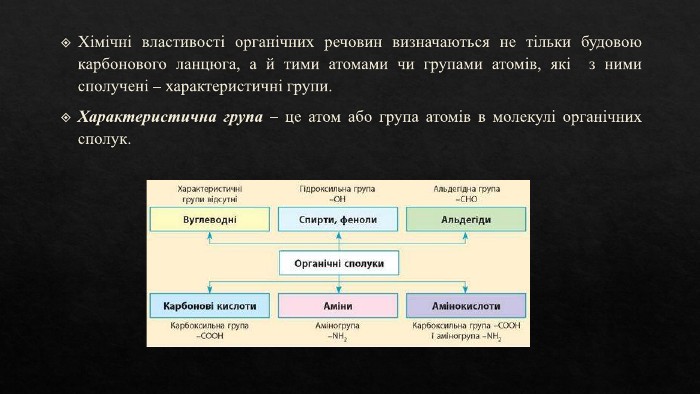
Ковалентні карбон-карбонові зв'язки
Про матеріал
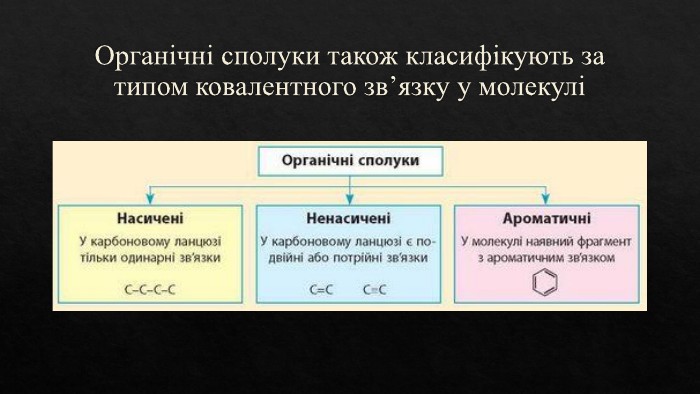
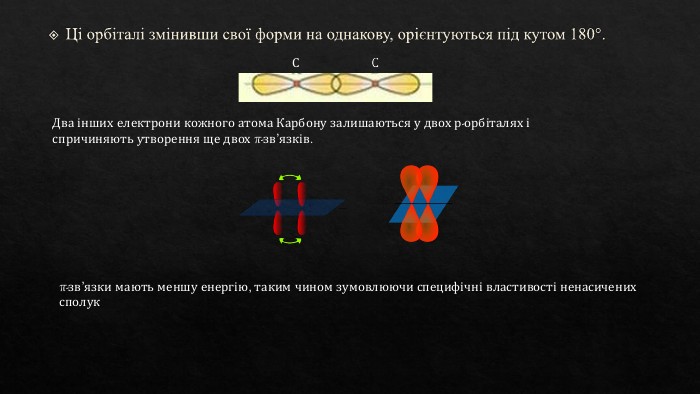
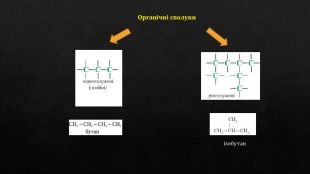
Ковалентні карбон-карбонові зв'язки. Класифікація за будовою карбонового ланцюга, за характеристичними групами, типом ковалентного зв'язку. Сигма та пі зв'язки. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку