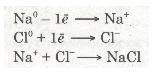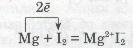ознайомити учнів з електронними формулами молекул,йонним зв’язком,його утворенням;навчити складати електронні формули молекул,визначати йонний зв’язок;виховувати пізнавальний інтер
ознайомити учнів з електронними формулами молекул,йонним зв'язком,його утворенням;навчити складати електронні формули молекул,визначати йонний зв'язок;виховувати пізнавальний інтерес до вивчення хімії.
Тип уроку: комбінований
Хід уроку
І.Організаційний момент
ІІ.Перевірка д.з.
ІІІ.Актуалізація опорних знань
Вивчення нового матеріалу
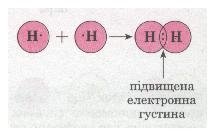
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
Тема уроку: Електронні формули молекул.Йони.Йонний зв’язок,його утворення.
Мета уроку:ознайомити учнів з електронними формулами молекул,йонним зв’язком,його утворенням;навчити складати електронні формули молекул,визначати йонний зв’язок;виховувати пізнавальний інтерес до вивчення хімії.
Тип уроку: комбінований
Хід уроку
І.Організаційний момент
ІІ.Перевірка д.з.
ІІІ.Актуалізація опорних знань
Вивчення нового матеріалу
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
Мал. 28. Схема утворення хімічного зв'язку.
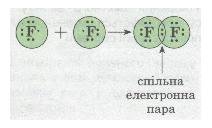
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2.
Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.
Різнойменно заряджені йони Натрію Na+ і Хлору Сl-, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:
Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.
Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.
Приклади речовин з йонним типом хімічного зв 'язку:
NaCl, NaBr, NaF, MgCl2, MgS, NaOH, Li2O, Ca3P2, AlCl3, BaO, KCl
Розглянь рівняння реакцій утворення деяких йонних сполук:
а) взаємодія магнію з йодом:
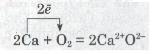
в) горіння алюмінію в бромі:
Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».
Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.
виконання лабораторного роботи
Висновки уроку
Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.
Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.
Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.
Завдання для самоконтролю
1. Що таке йонний зв'язок? Між якими елементами він виникає?
2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.
3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na2S; в) у кальцій нітриді Ca3N2. Поясни схеми.
4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н20, РН3, CaS, ZnCI2, SiH4, ССl4.
5. Запиши формули сполук, до складу яких входять такі йони: a) Na+ і Вr-; б) Са2+ і Сl-; в) К+ і S2+. Назви ці сполуки.
6. Яскраво виражений йонний зв'язок у парі атомів
(а) K—F; (в) F—F;
(б) 0—F; (г) P—F.
7. Хлор у сполуках утворює йонні зв'язки з
(а) К; (б) Н; (в) Са; (г) С.
Додаткові завдання
8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це
(а) Cu i F; (в) Na і F;
(б) C i N; (г) Li i Н.
9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.
10*. У натрій гідроксиді йонними є зв'язки
(а) між Натрієм і Оксигеном;
(б) між Гідрогеном і Оксигеном;
(в) між Натрієм і Гідрогеном;
(г) усі зв'язки.
11*. Порівняй будову йонів Мg2+ і F- з будовою атома Неону. Знайди подібні й відмінні ознаки.
12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?
13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?
Підбиття підсумків уроку
Домашнє завдання

про публікацію авторської розробки
Додати розробку