Практична робота з хімії 10 клас: “Розв’язування експериментальних задач”.
Урок
Тема: Практична робота: “Розв’язування експериментальних задач”.
Мета уроку: закріпити знання про хімічні властивості алюмінію, заліза та їх сполук; уміти експериментально доводити амфотерність алюмінію та його сполук, розрізняти сполуки Алюмінію, Феруму(ІІ) та Феруму(ІІІ), перевірити практичні навички учнів у розв’язанні експериментальних задач.
Обладнання: реактиви для проведення дослідів.
Тип уроку: практична робота.
Форми роботи: фронтальна бесіда, робота в групах, виконання експерименту, оформлення звіту про роботу.
Хід уроку
- Організаційний етап.
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій.
Перевірте, чи все необхідне для роботи знаходиться у вас на партах.
II. Актуалізація опорних знань учнів.
Фронтальна бесіда “Мікрофон”
- Які властивості мають сполуки Алюмінію?
- Що таке амфотерність?
- З якими речовинами можуть реагувати алюміній і залізо?
- Які ступені окиснення буде проявляти Алюміній, Ферум?
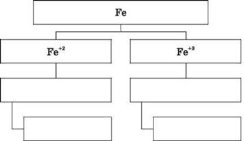
- Заповніть схему сполук заліза:
- Повторення правил техніки безпеки в кабінеті хімії, під час проведення хімічного експерименту, інструктування перед початком практичної роботи.
Правила безпеки під час роботи в кабінеті хімії
- Наливайте і насипайте реактиви над столом.
- Реактиви для дослідів беріть у малій кількості.
- Нюхайте речовини з обережністю.
- Якщо реактив потрапив на шкіру або одяг, ретельно змийте його водою (крім конц. сульфатної кислоти), а потім нейтралізуючою речовиною.
- Тримайте робоче місце в чистоті.
У РАЗІ НЕЩАСНОГО ВИПАДКУ НЕГАЙНО ЗВЕРТАЙТЕСЯ ДО ВЧИТЕЛЯ!
- Виконання практичної роботи.
Робота з індивідуальними картками.
Учні отримують індивідуальні картки з інструкціями для виконання практичної роботи.
- Дослідним шляхом здійснити перетворення:
![]()
![]() купрум (ІІ) оксид купрум (ІІ) сульфат купрум (ІІ) гідроксид
купрум (ІІ) оксид купрум (ІІ) сульфат купрум (ІІ) гідроксид
![]()
![]() купрум (ІІ) сульфат мідь
купрум (ІІ) сульфат мідь
CuO+H2SO4→CuSO4+H2O
CuSO4+2NaOH→Cu(OH)2+Na2SO4
H2SO4+Cu(OH)2→CuSO4+2H2O
Zn+CuSO4→Cu+ZnSO4
- Експериментально встановіть, чи взаємодіє ферум (ІІ) сульфат з:
а) лугом; б) міддю; в) барій хлоридом.
Розв'язання
А. В пробірку наливаємо 1мл розчину ферум (ІІ) сульфату і додаємо 1 мл розчинної основи – натрій гідроксиду. Реакція обміну, що відбувається в пробірці, може бути виражена рівнянням:
FeS04 + 2NaOH →Na2S04 + Fe(OH)2↓
Fe2++ S042- + 2Na++ 2OH- →2Na++ S042- + Fe(OH)2↓
Fe2++ 2OH- →Fe(OH)2↓ Випадає осад білого кольору.
На повітрі забарвлення стає зеленкуватим і далі бурим.
Б. В другу пробірку поміщаємо кілька шматочків мідного дроту, який попередньо очистили від оксидної плівки. Додаємо 2 мл концентрованого розчину ферум (ІІ) сульфату. Змін не спостерігаємо.
FeS04 + Cu —/—>
Мідь, як менш активний метал не відновлює залізо із розчину солі.
В. В третю пробірку наливаємо 1мл розчину ферум (ІІ) сульфату і додаємо краплями розчин барій хлориду. Спостерігаємо утворення білого дрібнокристалічного осаду:
FeS04 + BаСІ2 →FeСІ2 + BaS04↓
Fe2++ S042─ + Ba2++ 2Cl─ →Fe2++ 2Cl─ + BaS04↓
S042─ + Ba2+→BaS04↓
- Доберіть речовини, що відповідають таким скороченим йонним рівнянням реакцій:
- Ca2+ + CO32- = CaCO3
- NH4+ + OH- = NH3 + H2O
- Н+ +ОН- = Н2О
- СО32- +2Н+ = СО2 + Н2О.
- У трьох пронумерованих пробірках містяться розчини натрій хлориду, натрій гідроксиду і хлоридної кислоти. Доведи, у якій пробірці міститься кожний із них.
До кожної пробірки додаємо 1-2 краплі розчину індикатора, наприклад, лакмусу. У пробірці з лугом NaOH розчин набуде синього кольору, у пробірці з кислотою HCl розчин набуде червоного кольору. За допомогою індикатора розпізнали луг і кислоту. Довести наявність у пробірці натрій хлориду можна за допомогою розчину арґентум нітрату AgNO3, в результаті реакції утвориться білий сирнистий осад арґентум хлориду AgCl↓.
NaCl + AgNO3 = NaNO3 + AgCl↓
- Добудьте цинк гідроксид і доведіть практично, що він - амфотерна сполука.
Нерозчинні у воді основи добувають дією лугів на водні розчини відповідних солей.
До пробірки з розчином цинк хлоридом краплями додаємо розчину лугу NaOH, злегка струшуючи при цьому пробірку. Спостерігаємо утворення осаду у вигляді білої драглистої маси.
NaOH + ZnCl2 = NaCl + Zn(OH)2↓
Утворену драглисту масу поміщаємо у дві пробірки. До першої пробірки додаємо трохи розбавленої хлоридної кислоти, а до другої - розчину лугу. Спостерігаємо розчинення осаду у двох пробірках. Отже, реакції відбулися, цинк гідроксид прореагував з кислотою і лугом.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Отже, цинк гідроксид проявив подвійні хімічні властивості: у реакції з кислотою - основні, а у реакції з лугом - кислотні, тому він - амфотерна сполука.
- У трьох пронумерованих пробірках містяться розчин сульфатної кислоти, калій сульфату і калій гідроксиду. Доведіть, в якій з пробірок міститься кожний із них.
До кожної пробірки додаємо 1-2 краплі розчину індикатора, наприклад, лакмусу. У пробірці з лугом KOH розчин набуде синього кольору, у пробірці з кислотою H2SO4 розчин набуде червоного кольору. За допомогою індикатора розпізнали луг і кислоту. Довести наявність у пробірці калій сульфату можна за допомогою розчину барій хлориду BaCl2, в результаті реакції утвориться білий осад барій сульфату BaSO4↓.
K2SO4 + BaCl2 = 2KCl + BaSO4↓
- Узагальнення і систематизація знань.
Напишіть рівняння всіх виконаних вами реакцій у молекулярній, повній і скороченій йонній формах.
На підставі виконаних дослідів зробіть висновки:
- Як хімічним шляхом можна визначити якісний склад даної речовини?
- Чи існує зв'язок між класами неорганічних сполук? Відповідь обґрунтуйте.
- Домашнє завдання.
- VІІ. Підсумок уроку.


про публікацію авторської розробки
Додати розробку
