Презентація до інтегрованого уроку (хімія - фізика) «Подорож до царства Рудого біса»
Про матеріал
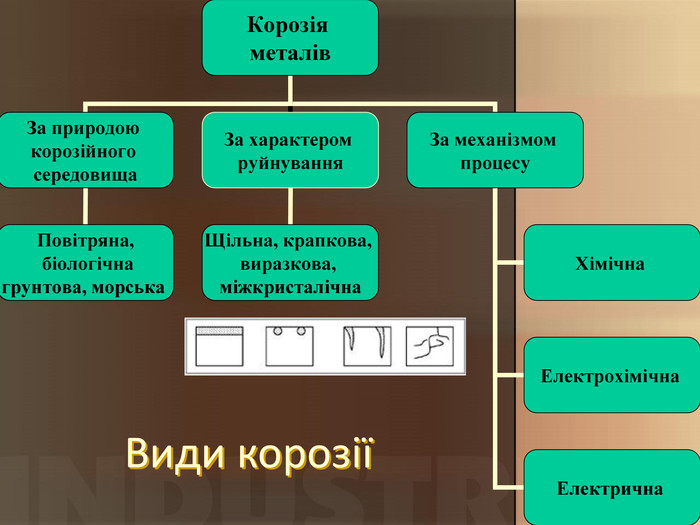
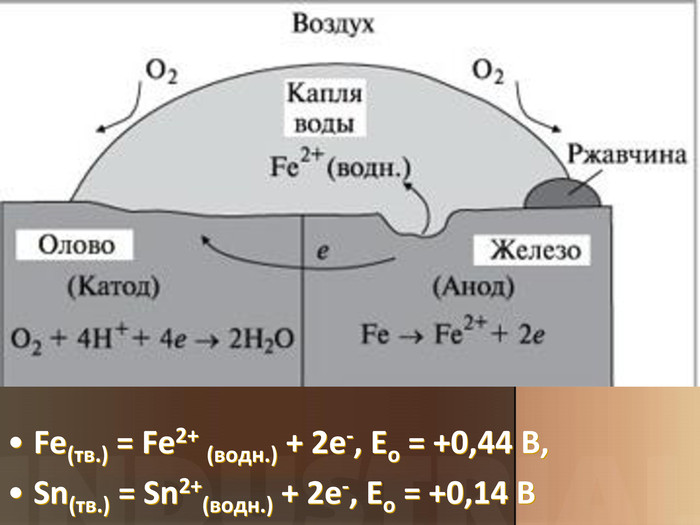
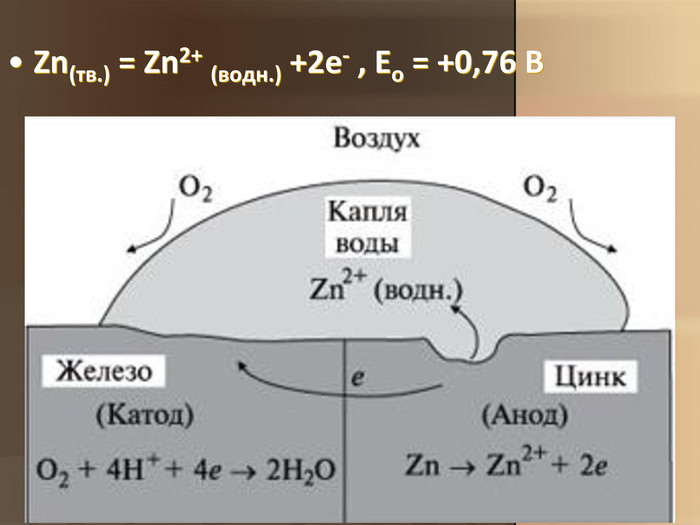
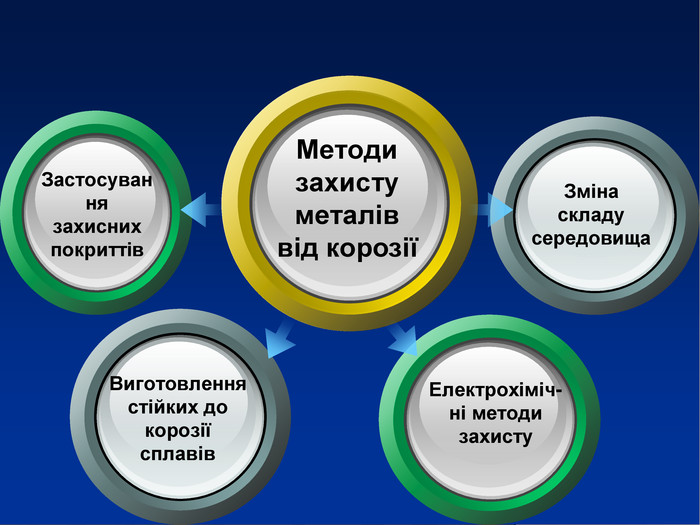
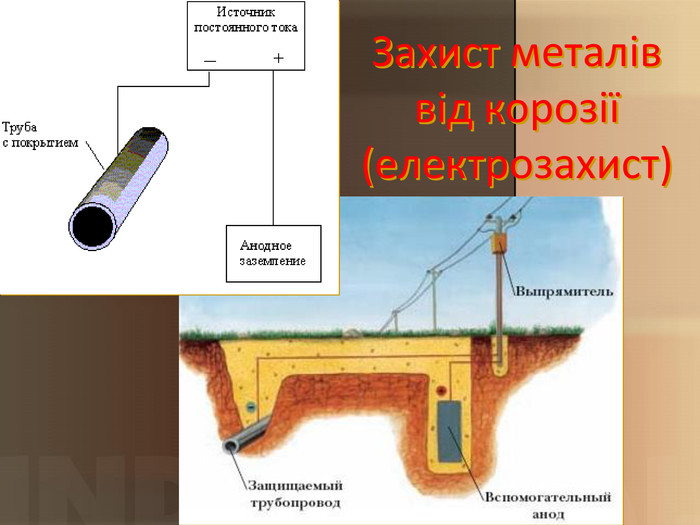
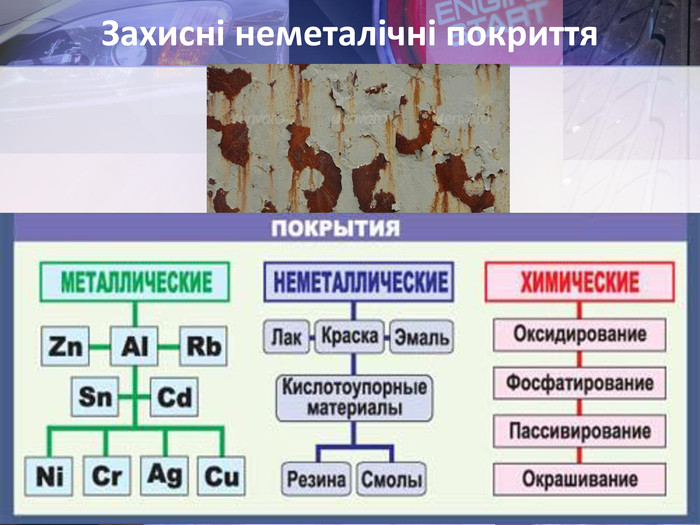
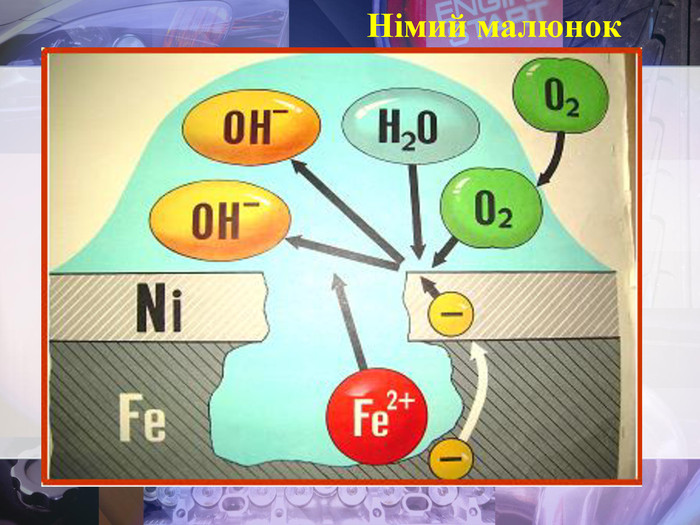
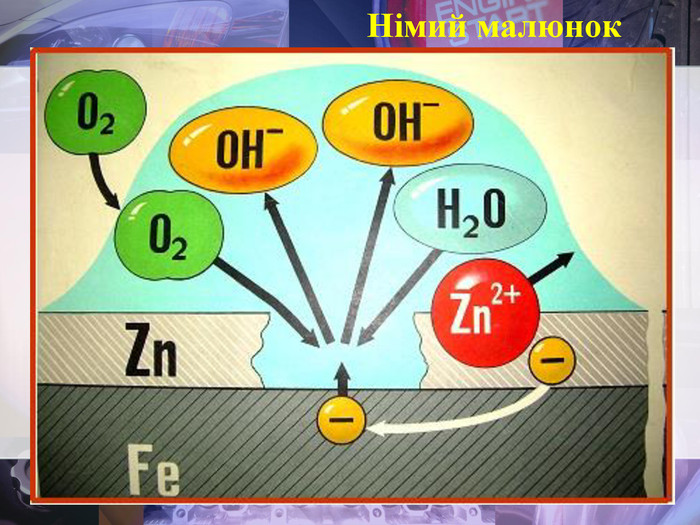
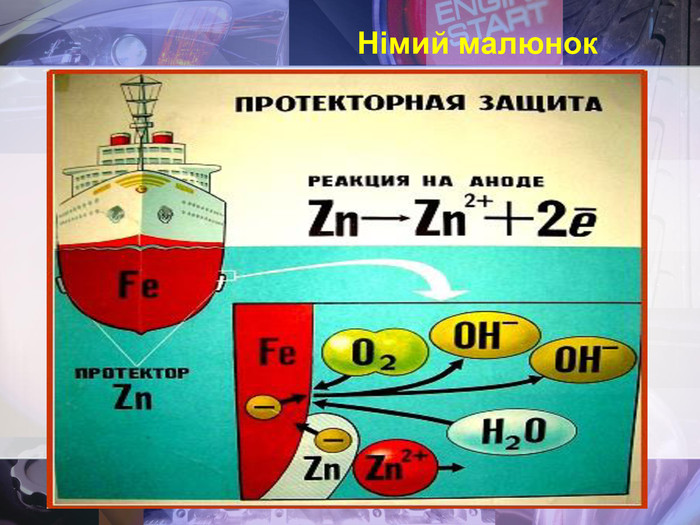
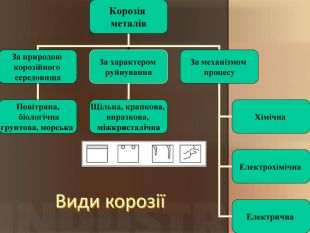
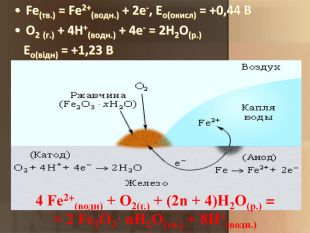
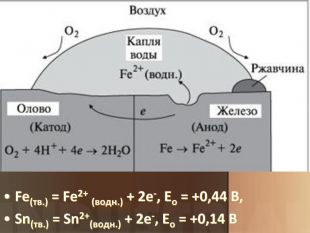
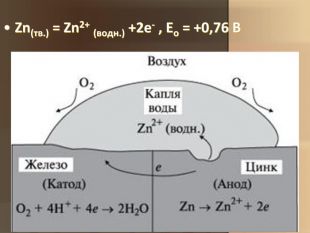
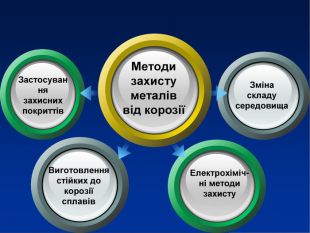
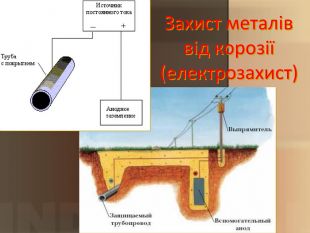
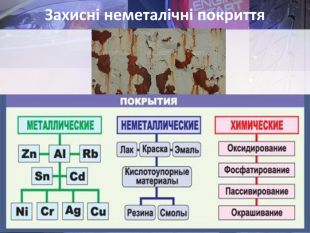
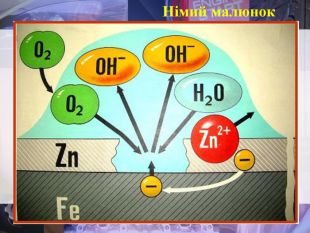
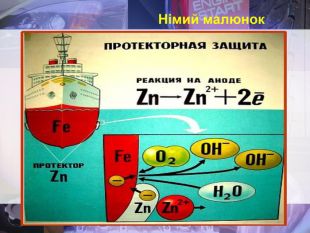
Учитель хімії: Діти! Сьогодні у нас не зовсім звичайний урок. Перед нами важка задача: подорож до царства «рудого біса». «Рудий біс» - це давній та небезпечний ворог більшості металів, які застосовують в побуті і техніці. Небезпека цього ворога в тім, що невидимий, він залишається завжди цілим та неушкодженим, а метали та сплави мають великі втрати. Ну як, здогадалися, що це за ворог?
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку