Презентація до уроку з теми "Фізичні і хімічні властивості кислот"






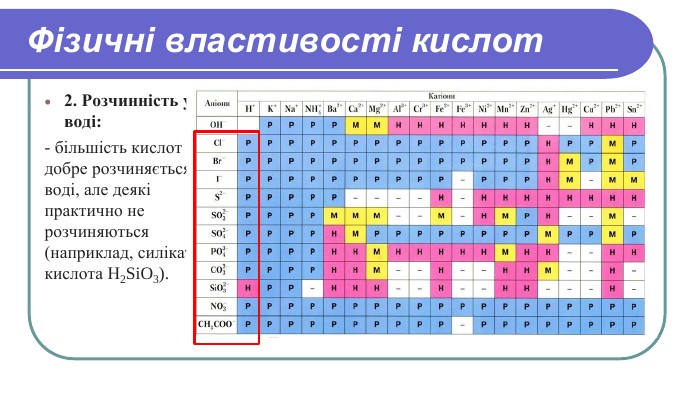

















Актуалізація опорних знань. Які класи неорганічних сполук ви знаєте?2) Які речовини називаються оксидами?3) Які речовини називаються основами?4) Які речовини називаються солями? 5) Які речовини називаються кислотами?7) Назвіть формулу нітратної кислоти. 6) Назвіть формулу хлоридної кислоти. 8) Назвіть формулу сульфатної кислоти. 9) Дайте назву речовинам: H2 SіO3, H2 СO3 , Н3 РО4
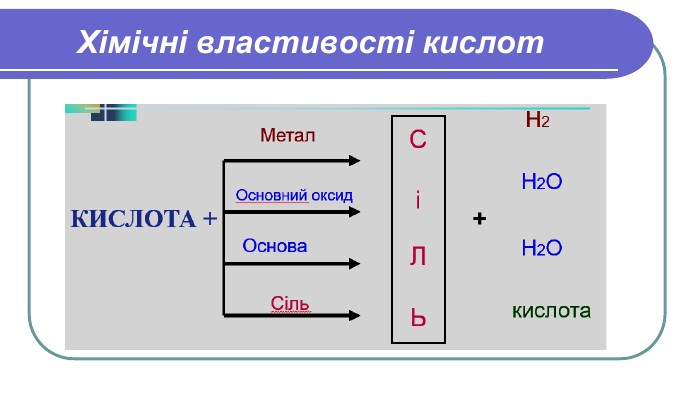
Познайомитися з хімічними властивостями кислот. Розширити знання про реакції заміщення й обміну на прикладі хімічних властивостей кислот. Сформувати уявлення про індикатори, витискувальний ряд металів. Розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот. Тема уроку: Фізичні й хімічні властивості кислот. Мета уроку:
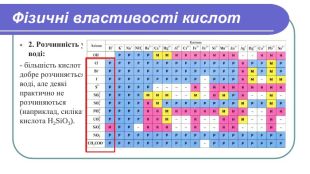
Сульфатна, хлоридна, оцтова кислоти можуть викликати сильні опіки, Тому при роботі з кислотами необхідно дотримуватися певних застережних заходів. Фізичні властивості кислот3 Важчі за воду.4. Водні розчини кислот відзначаються кислим смаком.5. Кислоти їдкі, руйнують рослинні і тваринні тканини.
Кислоти - їдкі речовини, тому поводитися з ними слід обережно:1. Уважно читайте етикетки на склянках2. Речовини для дослідів беріть не більше 1 - 2 мл3. Не залишайте склянки з кислотами відкритими4. Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий5. Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою6. Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:„Спочатку вода,Потім кислота.Інакше - трапиться біда!”7. Категорично забороняється проводити досліди, не зазначенні в роботі, та самостійно зливати та змішувати реактиви. Правила техніки безпеки при роботі з кислотами
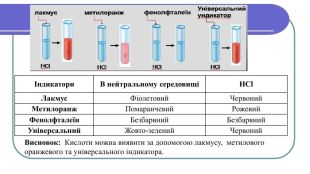
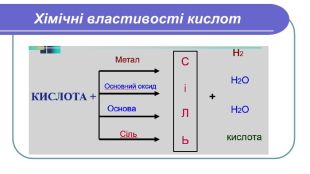
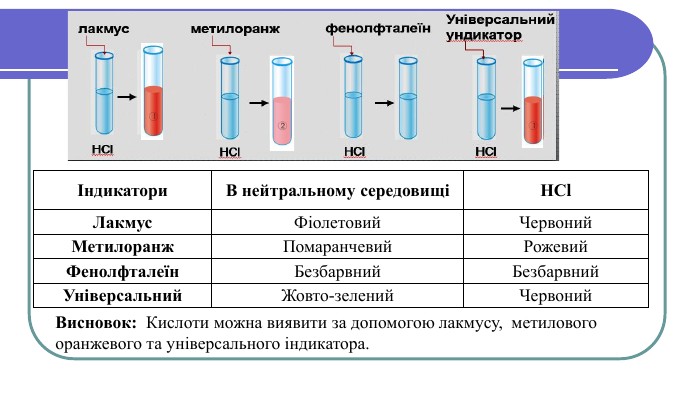
Хімічні властивості кислот1. Кислоти діють на індикатори, змінюючи їх колірІндикатори –речовини, які змінюють своє забарвлення під дією кислот або лугів. Лабораторний дослід №1 Тема. Дія кислот на індикатори Мета: визначити, який колір мають індикатори в кислотах. У 4 пробірки налийте по 1 мл хлоридної (HCl) або сульфатної ( H2 SO4) кислоти та додайте по краплі кожного індикатора (лакмусу, метилоранж, фенолфталеїну, універсального індикатора). Спостерігайте за зміною кольорів.
Індикатори. В нейтральному середовищіНСl. Лакмус. Фіолетовий. Червоний. Метилоранж. Помаранчевий. Рожевий. Фенолфталеїн. Безбарвний. Безбарвний. Універсальний. Жовто-зелений Червоний. Висновок: Кислоти можна виявити за допомогою лакмусу, метилового оранжевого та універсального індикатора.
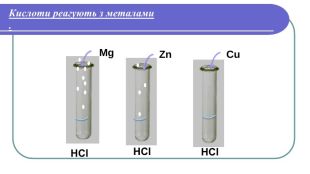
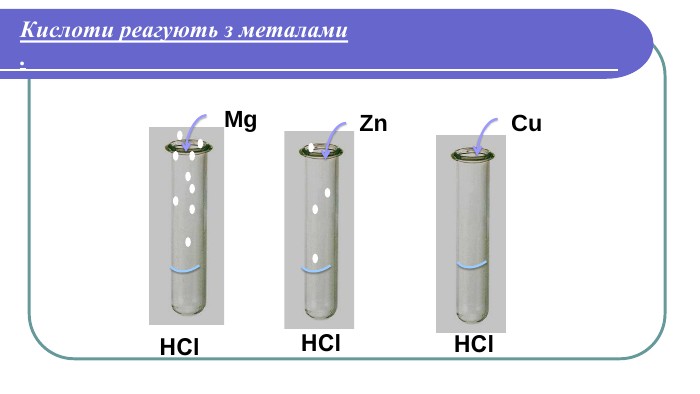
Хімічні властивості кислот2. Кислоти реагують з металами. Лабораторний дослід №2 Тема. Взаємодія кислот з металами. Мета: з’ясувати, чи всі метали реагують з кислотами; чи однаково активно реагують різні метали з кислотами. Хід роботи. У три пробірки налийте по 1 мл хлоридної (HCl) або сульфатної ( H2 SO4) кислоти . У першу пробірку покладіть шматочок магнію (Mg ), у другу – цинку (Zn), у третю – міді (Cu ). Що спостерігаєте? Чи всі метали реагують з кислотою? Чи однаково активно проходить реакція в кожній з пробірок?
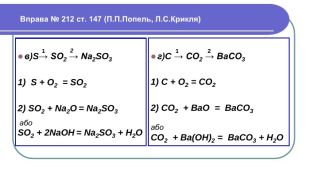
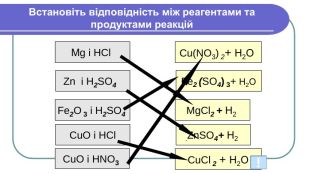
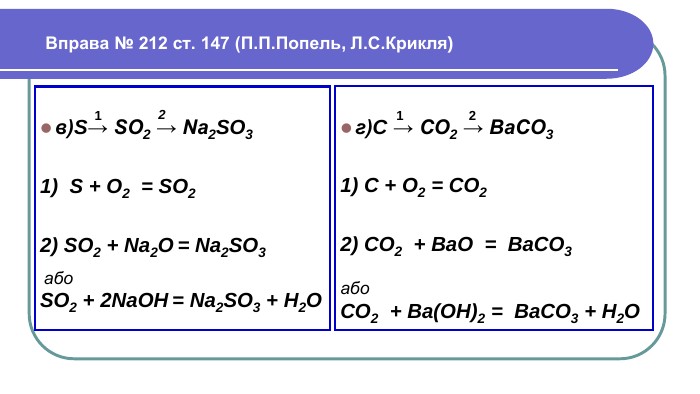
Напишемо рівняння реакцій. H2 Mg + HCl =Mg. Cl2 + 2 Zn + HCl =2 Zn. Cl2 + H2 Cu + HCl = Реакції заміщення – це хімічні реакції, що відбуваються між простою і складною речовиною, в процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і складну речовину. Увага! Нітратна та концентрована сульфатна кислоти реагують з металами накше. Водень не витісняється жодним із металів. метал + кислота = сіль + водень
Який можна зробити висновок?Висновок: 1. Метали, що стоять в ряду активності до Гідрогену (Н), _____________з кислотами Метали, що стоять в ряду активності після Гідрогену (Н), ____________з кислотами.2. Чим лівіше стоїть метал в ряду активності, тим він ________________ реагує з кислотами.реагують не реагують активніше

про публікацію авторської розробки
Додати розробку