Презентація «Кристалічні гратки» 8 клас
Про матеріал
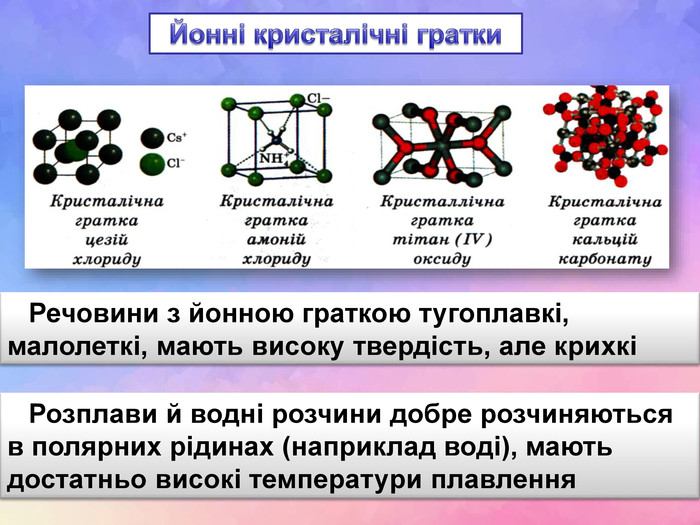
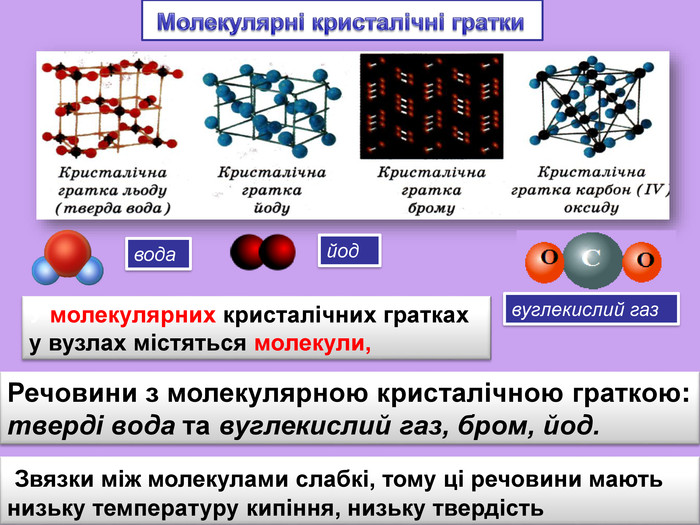
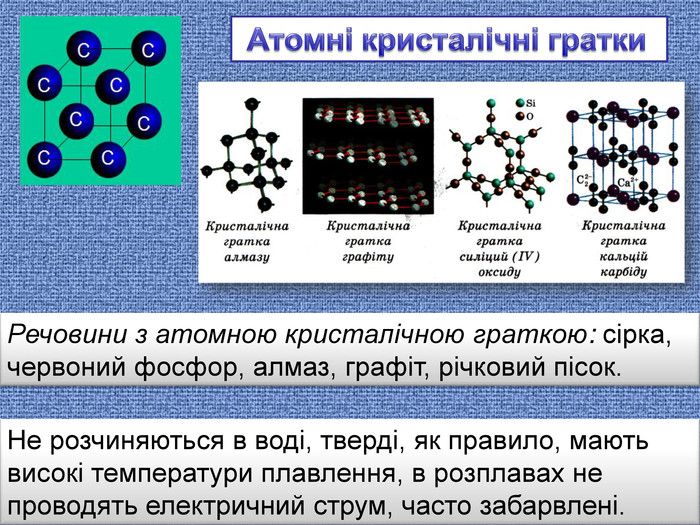
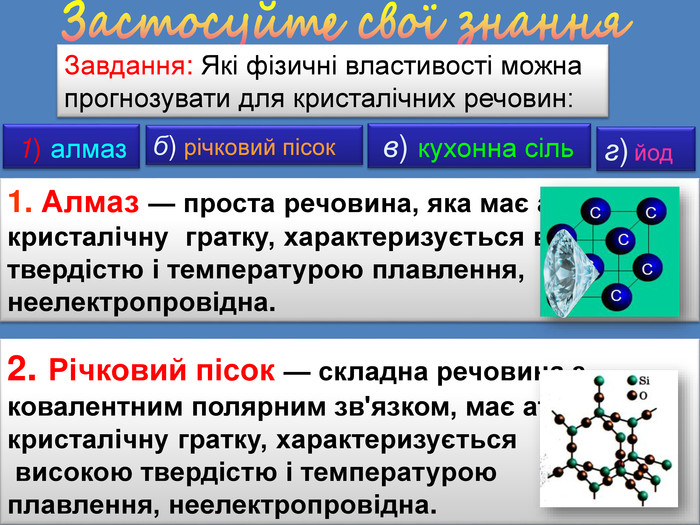
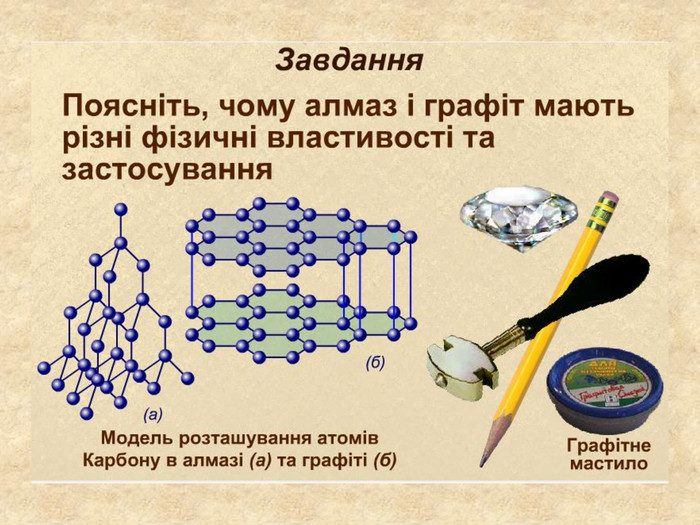
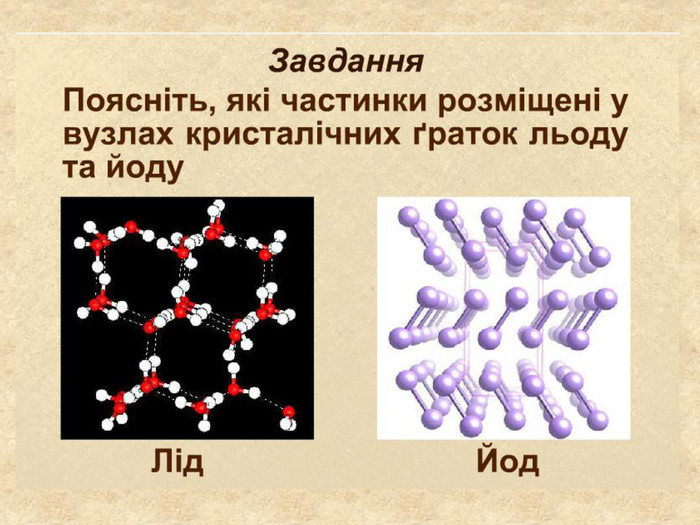
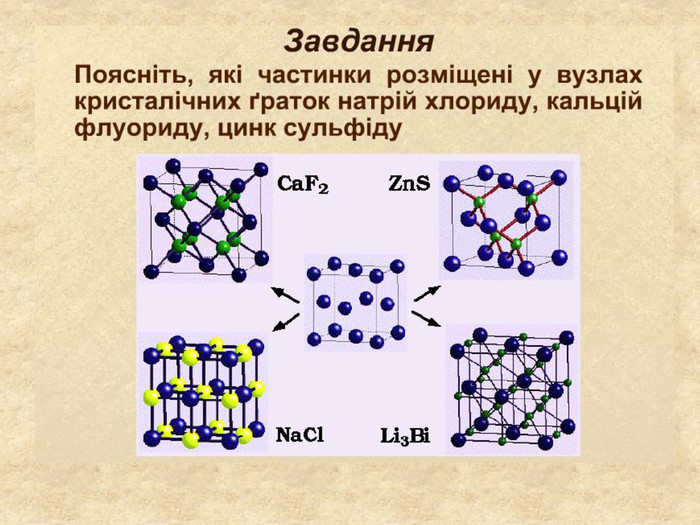
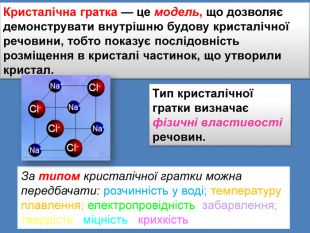
| Презентація допоможе в проведенні уроку на тему: «Кристалічні ґратки». Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґраток. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



















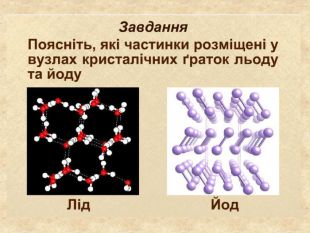
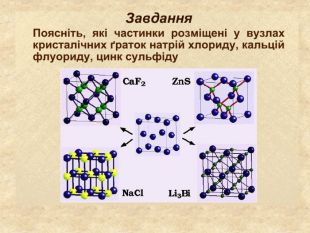


-

Гурська Оксана Вікторівна
22.11.2024 в 20:33
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
18.11.2024 в 23:47
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Забара Оксана Василівна
20.11.2023 в 00:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Міхеєва Наталія Федорівна
06.12.2022 в 21:40
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коріненко Світлана Іванівна
01.12.2022 в 16:07
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Радченко Тетяна Василівна
15.11.2022 в 15:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
08.11.2022 в 19:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кріт Галина Василівна
25.10.2022 в 22:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

П'яненко Олена Василівна
16.11.2021 в 18:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мадера Світлана
24.10.2021 в 22:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підіпригора Олена
23.12.2020 в 20:32
Велике дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коробка Ігор Валерійович
14.12.2020 в 19:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Папіровник Оксана Вікторівна
28.11.2020 в 17:32
Чітко , доступно, зрозуміло. Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Скряга Наталя Миколаївна
03.12.2019 в 14:28
Презентація чудова, матеріал викладений доступно, наглядно і системно.Дякую дуже!!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гутнік Тетяна Павлівна
02.12.2019 в 19:56
Дякую за роботу. Використала на своєму уроці. Значно скоротила час при підготовці до заняття
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Шевякова Юлія Миколаївна
26.11.2018 в 18:30
Дуже сподобалась презентація, все чітко і суттєво!! Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 13 відгуків