Презентація «Йони». 8 клас
| Презентація допоможе в проведенні уроку на тему: «Йоний зв'язок».( Для подолання труднощів у роозумінні понять йони). |



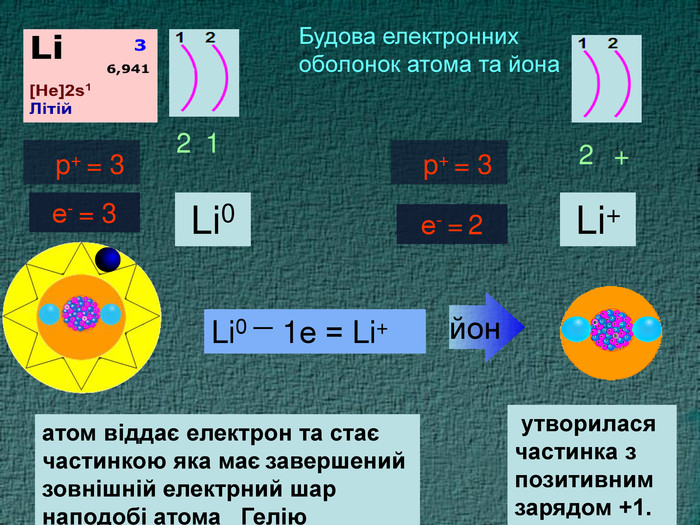






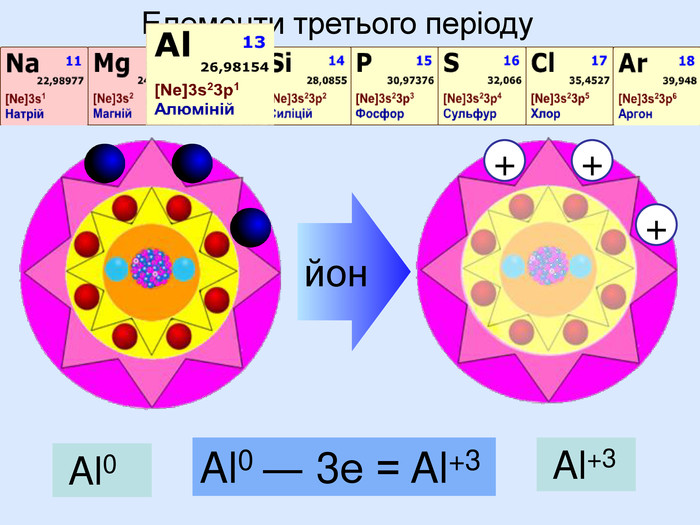







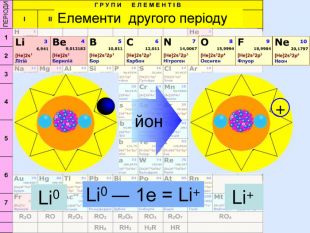
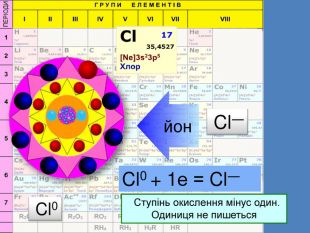
Li0 Число над знаком хімічного елемента називається ступінь окиснення. ступінь окиснення вказує на кількість відданих чи приєднаних електронів в даному випадку ступінь окиснення― ноль. Це означає, що атом електронейтральній, тобто в наявності всі електрони. Li+ В цьому випадку ступінь окиснення ― плюс один (одиниця не пишеться) Це означає, що атом “віддав” один електрон, перетворившись на позитивно заряджений йон катіон
Li0 Як називається число над знаком? На що вказує ступінь окиснення ? в даному випадку ступінь окиснення― ноль. Що це означає? Li+ Прокоментуйте цей випадок. Що це означає ?Число над знаком хімічного елемента називається ступінь окиснення. ступінь окиснення вказує на кількість відданих чи приєднаних електронів Це означає, що атом електронейтральній, тобто в наявності всі електрони. В цьому випадку ступінь окиснення ― плюс один (одиниця не пишеться) Це означає, що атом “віддав” один електрон, перетворившись на позитивно заряджений йон катіон
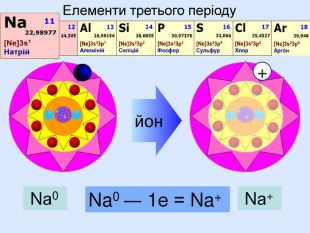
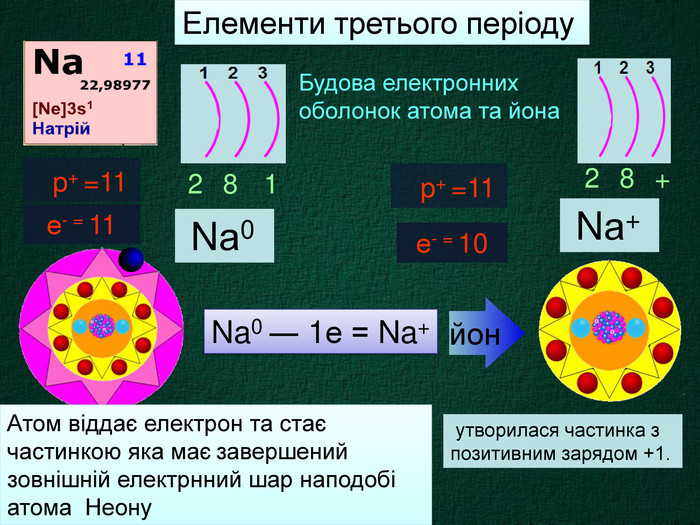
Nа0 Число над знаком хімічного елемента називається ступінь окиснення. ступінь окиснення вказує на кількість відданих чи приєднаних електронів в даному випадку ступінь окиснення― ноль. Це означає, що атом електронейтральний, тобто в наявності всі електрони. Nа+ В цьому випадку ступінь окиснення ― плюс один (одиниця не пишеться) Це означає, що атом “віддав” один електрон, перетворившись на позитивно заряджений йон катіон
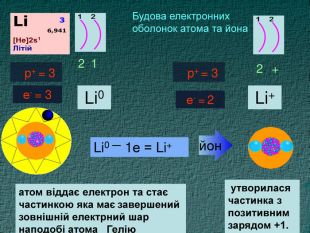
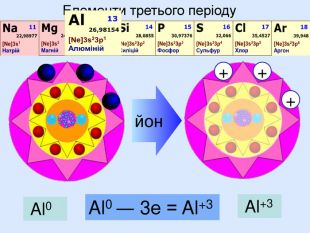
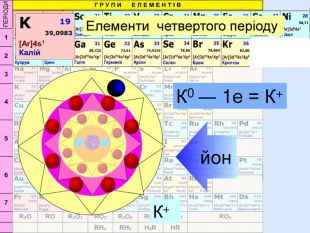
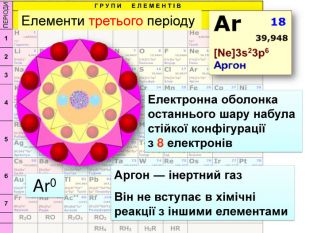
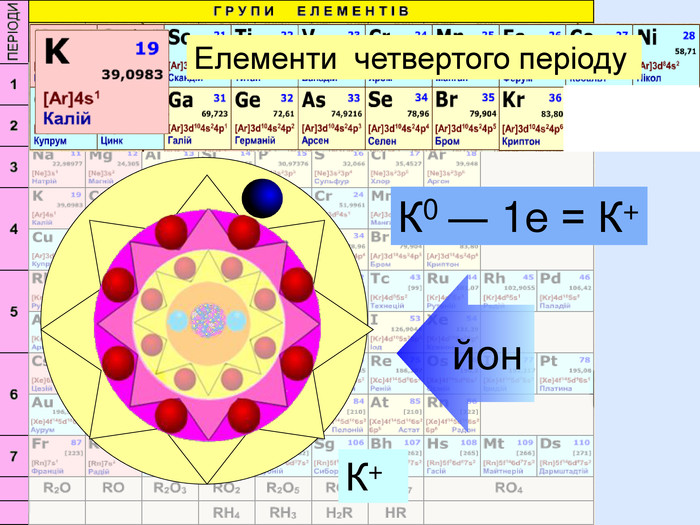
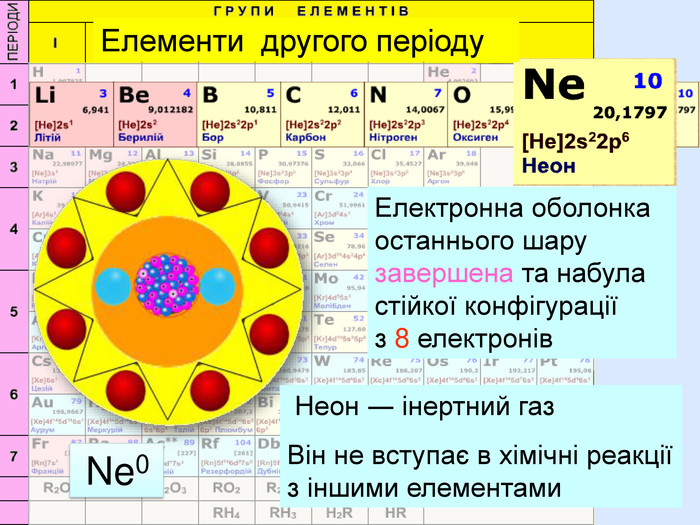
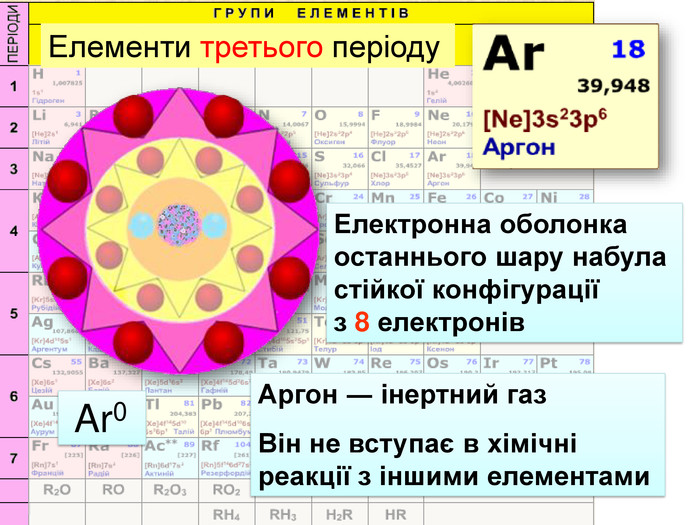
Атом натрію має заряд ядра +11, тобто 11 протонів та 11 електронів. Знаходиться в третьому періоді, тому має три електронні шари. На останньому шарі один електрон. При віддачі електрона він стає позитивно зарядженим йоном, якій має назву катіон. Йон натрію має іншу будову електронної оболонки, ніж його нейтральний атом. В ядрі атома ― 11 протонів, але 10 електронів. Не три, а два електронних шари. Зовнішній електронний шар завершений, як у атома неону.
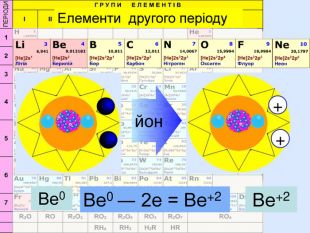
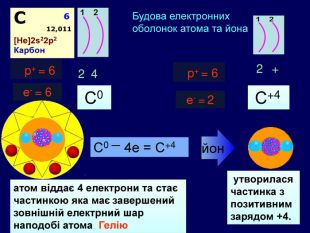
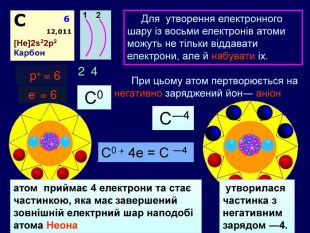
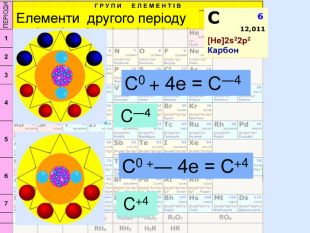
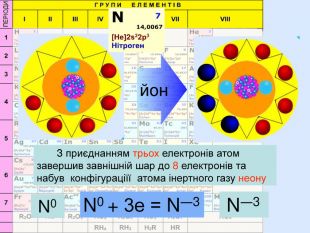
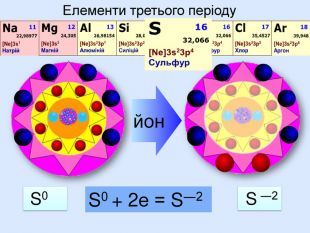
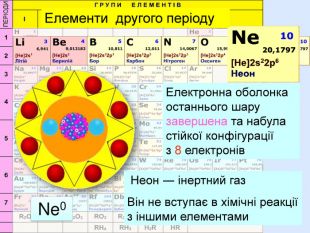
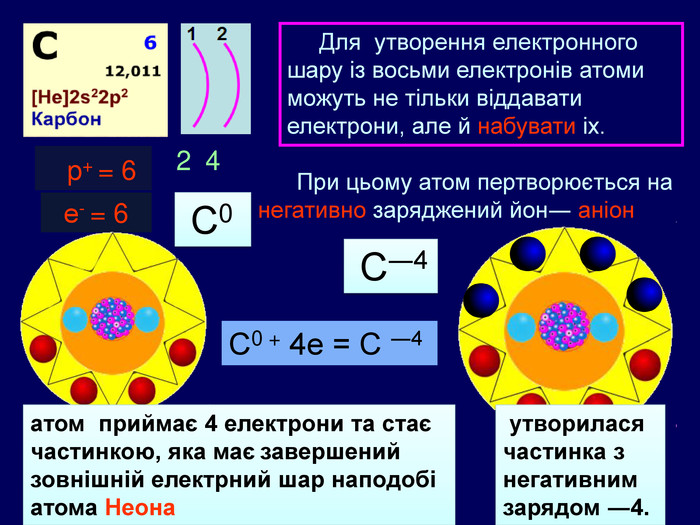
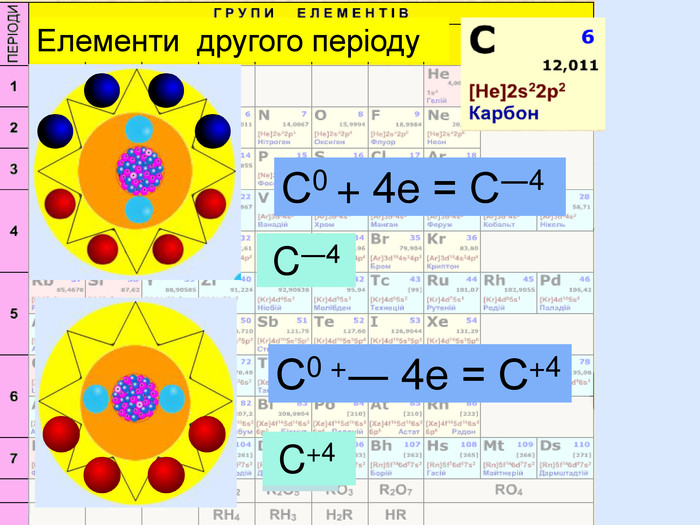
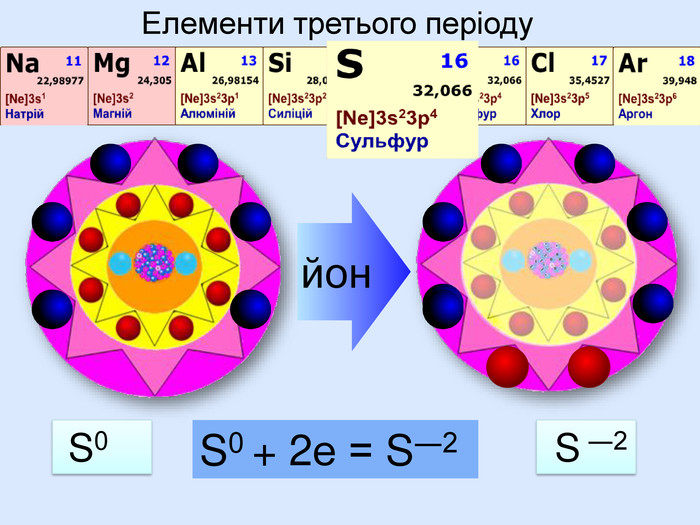
Для утворення електронного шару із восьми електронів атоми можуть не тільки віддавати електрони, але й набувати іх. При цьому атом пертворюється на негативно заряджений йон― аніон24 p+ = 6е- = 6 С0 С0 + 4е = С ―4атом приймає 4 електрони та стає частинкою, яка має завершений зовнішній електрний шар наподобі атома Неона утворилася частинка з негативним зарядом ―4. С―4
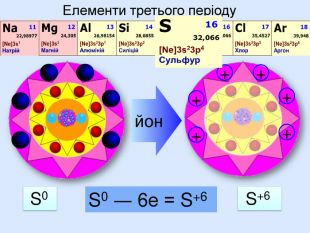
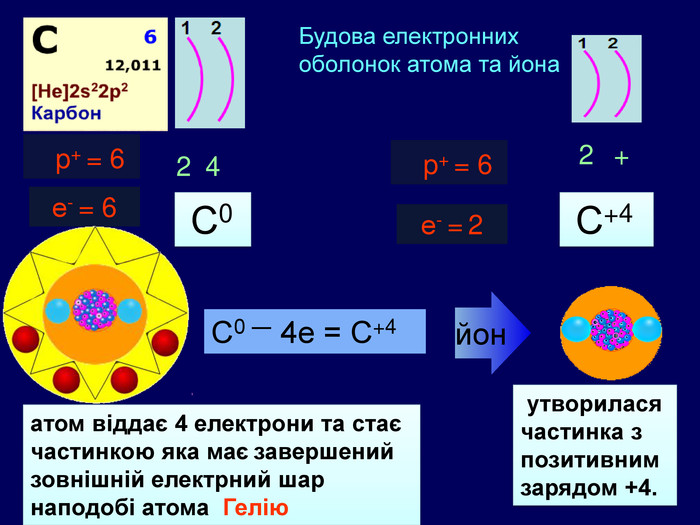
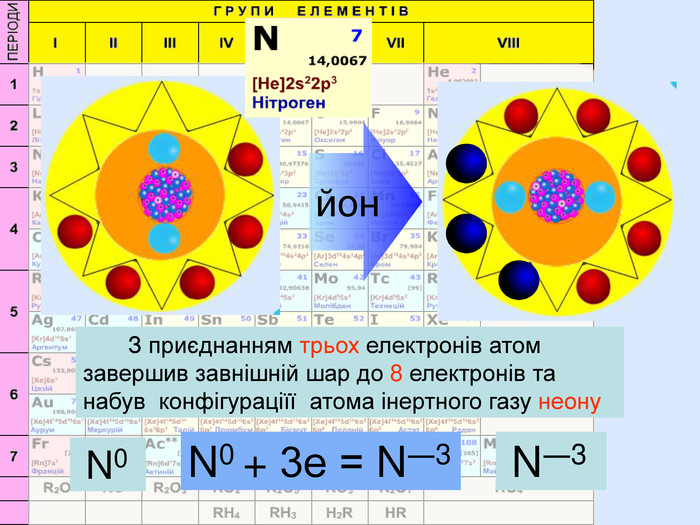
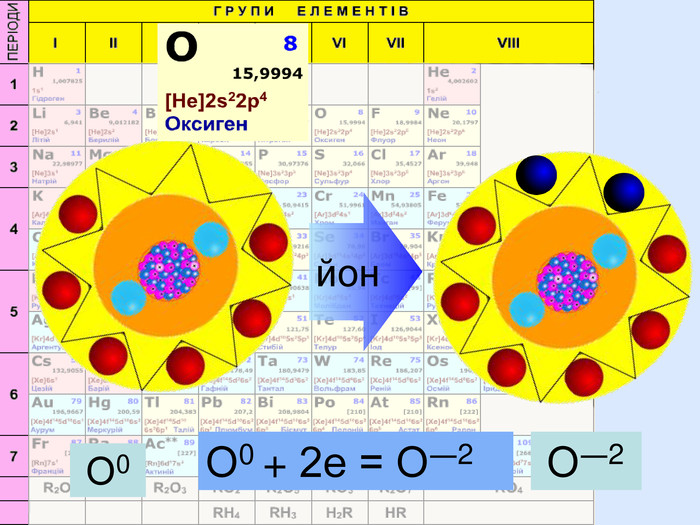
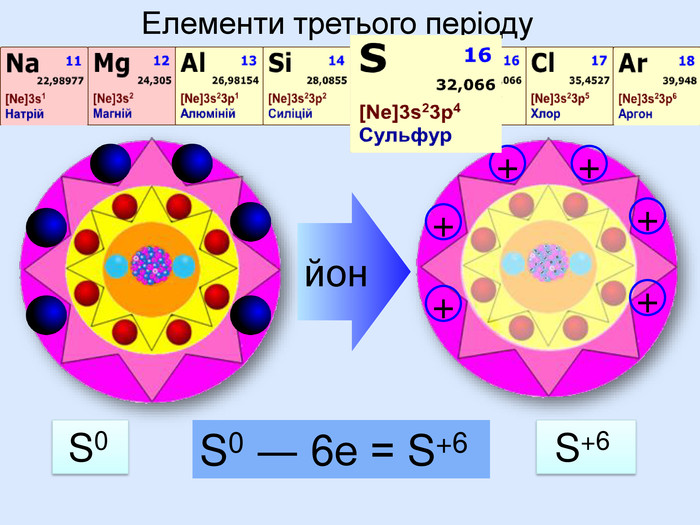
Йони ― це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп внаслідок втрати або приєднання до них електронів S+6 К+ Al+3 катіони Атоми, які втратили електрони та перетворилися на позитивно заряджені йони S ―2 C―4 N―3 аніони Атоми, які приєднали електрони та перетворилися на негативно заряджені йони
Григорович О. В. Хімія: підруч. для 8 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2016 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с.

про публікацію авторської розробки
Додати розробку