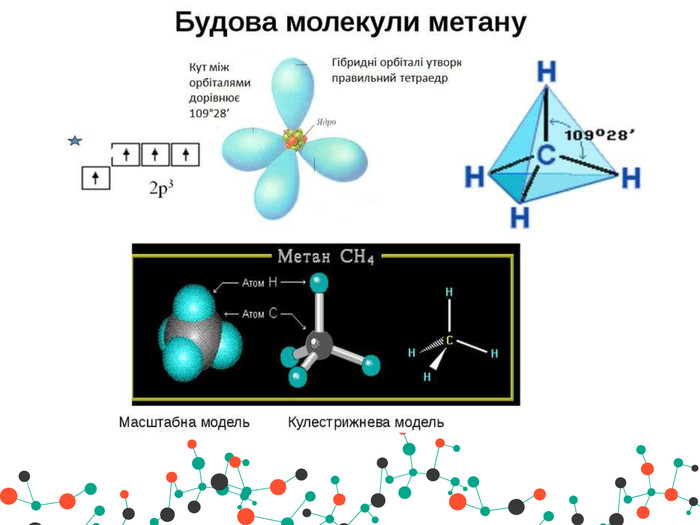
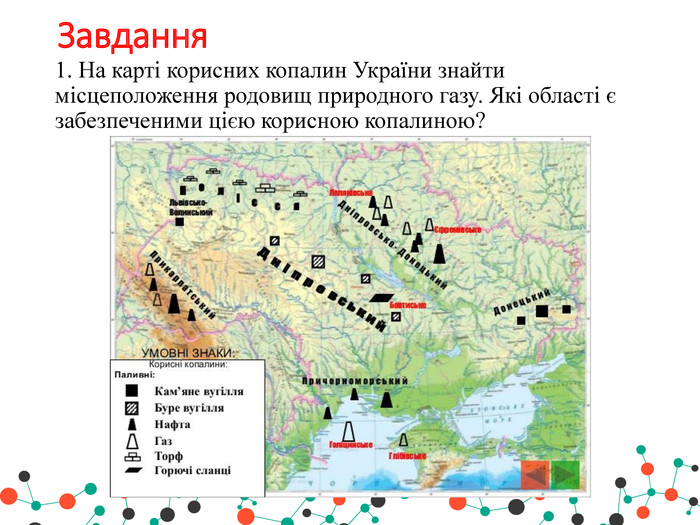
Презентація " Метан та його властивості"
Про матеріал
Дана презентація може бути застосована як на уроці так і для "перевернутого навчання" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку