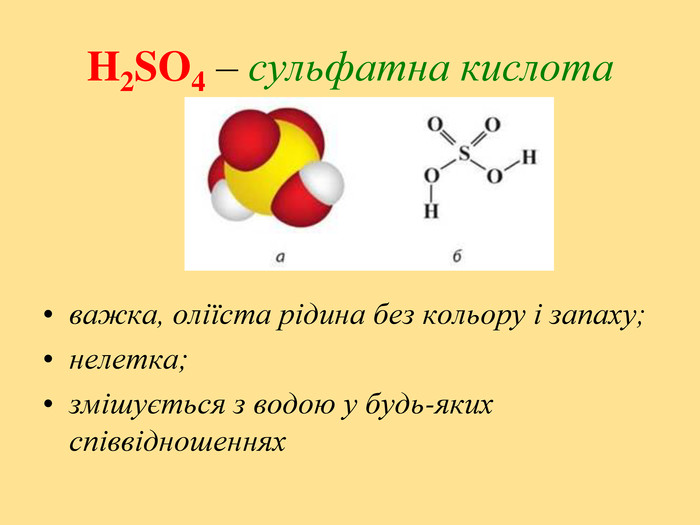
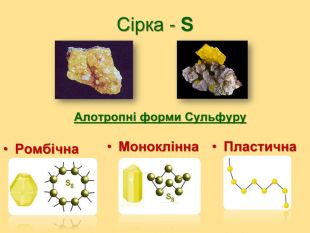
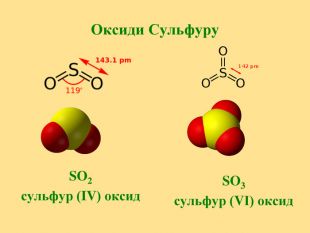
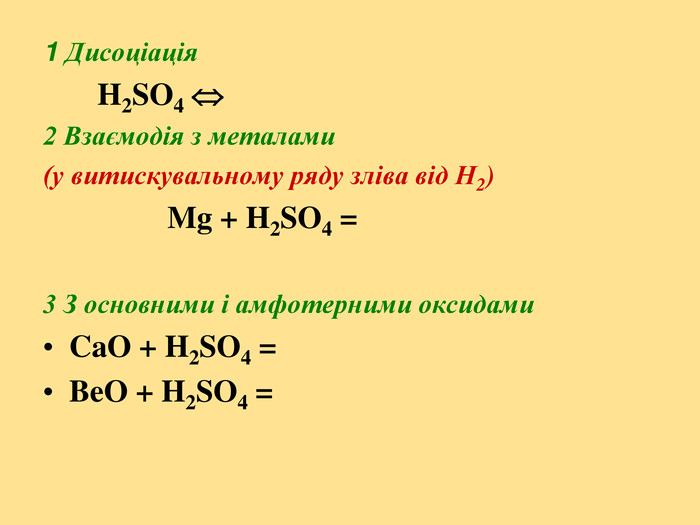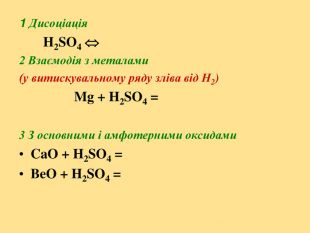Презентація на тему "Оксиген і Сульфур"
Про матеріал
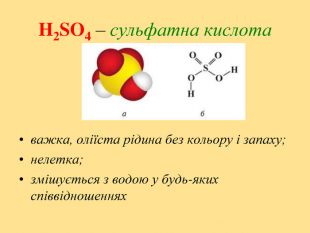
Ознайомитись із положенням Оксигену і Сульфуру у періодичній системі елементів Д.І.Менделєєва; будовою атомів, вивчити фізичні та хімічні властивості кисню і сірки; вивчити фізичні та хімічні властивості сполук Сульфуру; поширення в природі та застосування кисню, сірки та сполук Сульфуру.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
ppt
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку