ПРЕЗЕНТАЦІЯ УРОКУ ХІМІЇ Загальна характеристика металічних елементів
Про матеріал
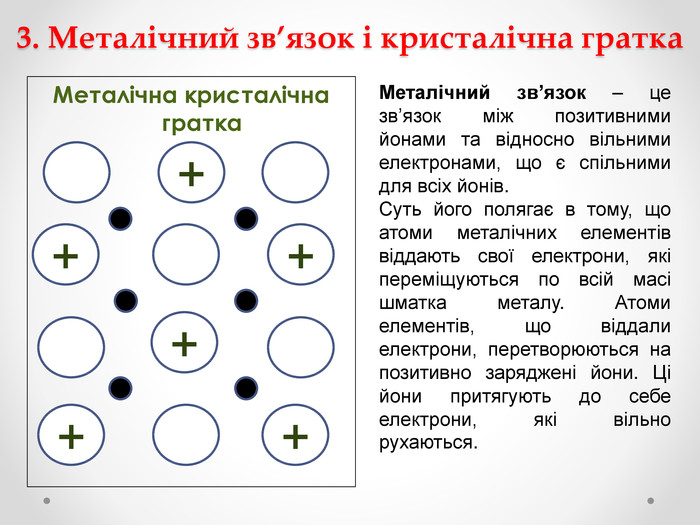
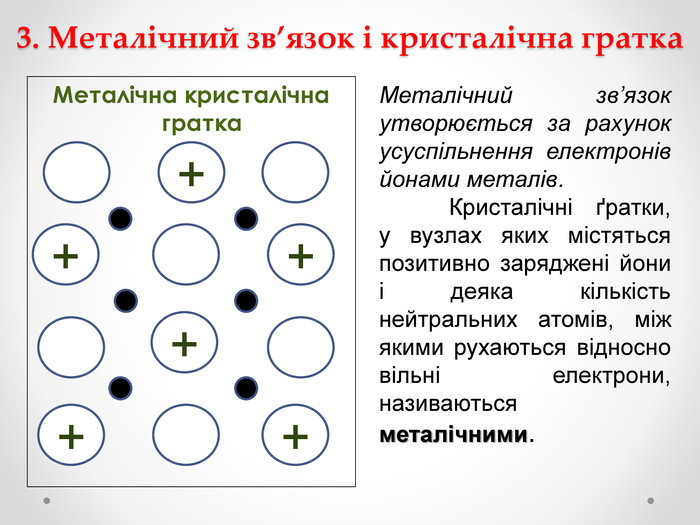
Тема: Загальна характеристика металічних елементів.
Мета: дати загальну характеристику металічним елементам за їх положенням у періодичній системі та будовою атомів і простих речовин металів; пояснити механізм утворення металічного зв'язку; ознайомити учнів з новим типом кристалічної гратки – металічною; навчити учнів характеризувати фізичні властивості металів; розглянути знаходження металів у природі.
Тип уроку: засвоєння нових знань.
Методи: бесіда, розповідь, пояснення, демонстрація, розв'язування вправ.
Обладнання та матеріали: Періодична система хімічних елементів Д.І. Менделєєва; металічні вироби; персональний комп'ютер, мультимедійна система.
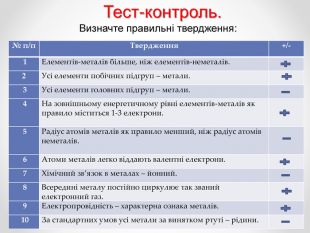
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дуже хороша розробка. Дякую вам за творчий підхід та професіоналізм.


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку