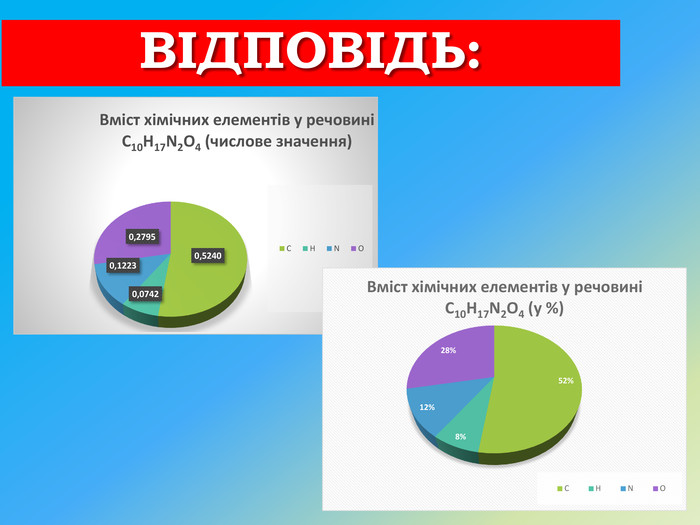
Презентація з хімії 8 клас на тему Кількість речовини. Моль - одиниця кількості речовини. Стала Авогадро".
Про матеріал
Презентація з хімії 8 клас на тему Кількість речовини. Моль - одиниця кількості речовини. Стала Авогадро" з використанням практичної частини. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку