Урок "Електролітична дисоціація кислот, основ, солей у водних розчинах"
Тема 2: Електролітична дисоціація кислот, основ, солей у водних розчинах.
Мета:
- поглибити знання учнів про електролітичну дисоціацію на прикладі розчинів кислот, основ і солей;
- формувати навички складання рівнянь дисоціації на прикладі розчинних кислот, основ, солей.
- уточнити визначення кислот, основ, солей у світлі теорії електролітичної дисоціації.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь , лабораторна робота, самостійна робота.
Обладнання: таблиця розчинності, схема дисоціації ,реактиви для дослідів.
Хід уроку.
І. Організаційний етап.
ІІ. Перевірка Д/З.
Актуалізація опорних знань.
Учні біля дошки пояснюють дисоціацію на прикладі НСІ і NаСІ за схемами.
Фронтальне опитування.
- Що таке електролітична дисоціація?
- Наведіть основні положення електролітичної дисоціації.
- Сполуки яких класів належать до електролітів?
- Який тип зв’язку характерний для неелектролітів?
ІІІ. Мотивація навчальної діяльності.
Інструктаж з ТБ.
Дослід №1. Визначення йонів Н+ і ОН- у розчинах. дослідження універсальним індикаторним папірцем йони кислот та аніони гідроксогрупи. Фенолфталеїн – тільки йони ОН-
Лакмус стає червоним для Н+
Висновок: у розчинах кислот міститься Н+, у розчинах лугів – ОН-
НСІ→ Н++СІ-
КОН→ К++ОН-
ІV. Поглиблення знань.
Отримані результати дозволяють уточнити визначення кислот, основ і солей.
Кислоти – це електроліти, у результаті яких у розчинах утворюється лише один вид катіонів.
HNO3→ H++NO3-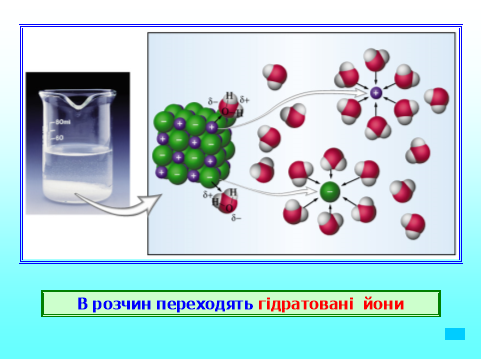
H2SO4→ H++HSO4-
HSO4-→ H++SO42-
H3PO4→
Основи – це електроліти, у результаті дисоціації яких у розчин7і утворюється лише один вид аніонів йони ОН-
Ca(OH)2→ CaOH- +OH-
CaOH-→ Ca2++ 2OH-
Ba(OH)2→
Солі - це електроліти, у результаті дисоціації яких у розчині утворюються катіони металів і аніони кислотних залишків.
Al2(SO4)3 → 2AL3++3SO42-
AL(NO3)3→
V. Самостійна робота. Узагальнення знань.
Написати рівняння дисоціації речовин.
ZnCL2 MgSO4 Ba(OH)2 ALCL3 Mg3(PO4)2 Ba(NO3)2
VI. Підбиття підсумків. Д/З.

про публікацію авторської розробки
Додати розробку
