Урок "Ковалентні карбон-карбонові зв’язки в молекулах органічних речовин. Класифікація органічних речовин"
Тема: Теорія будови органічних сполук.
Тема уроку: Ковалентні карбон-карбонові зв’язки в молекулах органічних речовин. Класифікація органічних речовин
Мета уроку:
навчальна: розширити і поглибити знання учнів про класи вуглеводнів,
ознайомити учнів з основними характеристиками ковалентного зв’язку, порівняти за цими характеристиками одинарний, подвійний та потрійний зв'язок, показати взаємозв’язок будови та властивостей вуглеводнів;
розвиваюча: розвивати вміння порівнювати речовини, робити висновки про їх властивості на основі будови і навпаки, формувати навички самостійної роботи;
виховна: виховувати критичність мислення, цілеспрямованість;
корекційна: розвивати вміння працювати самостійно; розвивати інтерес до вивчення предмету, формування цілеспрямованості.
Тип уроку: урок засвоєння нових знань.
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Ключові компетентності: компетентності в галузі природничих наук, техніки і технологій, навчання впродовж життя.
Обладнання: моделі молекул вуглеводнів різних класів (метану, етену, етину, бензену)
ХІД УРОКУ
Бесіда:
Які органічні речовини називають вуглеводнями?
В чому полягає відмінність між ними?
Основою систематизації органічних сполук є теорія будови. Як її основні положення?
Чи бдуть ізомерами С3Н8 і С6Н14?
Вивчення нового матеріалу
Згідно з сучасними уявленнями усі особливості органічних сполук пов’язані з властивостями елемента Карбону.
Кратні зв'язки
Зв'язки, що зустрічаються в органічних сполуках, подвійні або потрійні:
CH2 = CH2 R2C=O
Утворюються при узагальненні двома атомами більш ніж однієї пари електронів:
Н2С : : СН2; R2С : : О; HС : : : CH; RС : : : N і т.д.
Кратні зв'язки є поєднанням σ- і π-зв'язків.
Подвійний зв'язок побудований з одного σ - і одного π -зв'язку і утворюється 4 загальними електронами.
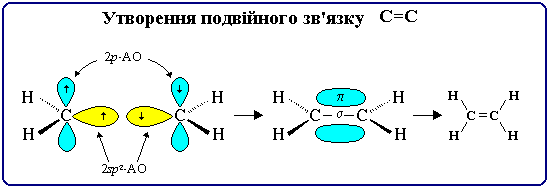
Ковалентний зв'язок
В органічних сполуках цей тип зв'язку є основним. Ковалентний зв'язок виникає між атомами з відносно малими відмінностями в значеннях електронегативності (∆χ< 2), наприклад, С і Н, С і О, С і N, C і Cl, N і O і т.п., які утворюють хімічний зв'язок за рахунок спільної електронної пари:
H : H H : C C : C C : O
- Зв'язок, утворений шляхом узагальнення пари електронів атомів, що його утворюють, називається ковалентним
Цей зв'язок може розглядатися як електростатичне притягання ядер двох атомів до загальної електронної пари. Ковалентний зв'язок, на відміну від йонного, певним чином спрямований (від атома до атома), і його позначають валентною межею, яка символізує цю спрямованість: Cl - Cl, H - CH3.
Йонний зв'язок точніше відображається знаками зарядів йонів: Na+Cl-.
Для речовин з ковалентним зв'язком характерна молекулярна будова (молекулярні кристалічні гратки), вони мають відносно низькі температури плавлення і кипіння. Такі речовини малополярні, погано розчинні у воді, їх розчини не проводять електричний струм.
Властивості ковалентного зв'язку
Характерні властивості ковалентного зв'язку - спрямованість, насиченість, полярність, поляризованість - визначають хімічні і фізичні властивості органічних сполук.
Спрямованість зв'язку обумовлює молекулярну будову органічних речовин і геометричну форму їх молекул. Кути між двома зв'язками називають валентними.
Насиченість - здатність атомів утворювати обмежене число ковалентних зв'язків. Кількість зв'язків, утворюваних атомом, обмежена числом його зовнішніх атомних орбіталей.
Полярність зв'язку обумовлена нерівномірним розподілом електронної густини внаслідок відмінностей в значеннях електронегативності атомів. За цією ознакою ковалентні зв'язки поділяють на неполярні і полярні.
Поляризованість зв'язку виражається в зсуві електронів зв'язку під впливом зовнішнього електричного поля, у тому числі і іншої реагуючої частинки. Поляризованість визначається рухливістю електронів. Електрони тим рухоміше, чим далі вони знаходяться від ядер.
Полярність і поляризованість ковалентних зв'язків визначає реакційну здатність молекул по відношенню до полярних реагентів.
Важливими кількісними характеристиками ковалентного зв'язку є енергія зв'язку, її довжина.
- Енергія зв'язку - енергія, що виділяється при її утворенні, або необхідна для розриву двох зв'язаних атомів. Енергія зв'язку характеризує міцність зв'язку.
- Довжина зв'язку - відстань між центрами зв'язаних атомів. Чим менше довжина, тим міцніше хімічний зв'язок.
Чим вище полярність зв'язку, тим більше її енергія і менше довжина. На характеристики зв'язків впливає їх кратність:
-
енергія зв'язку збільшується в ряду:
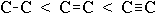 ;
;
-
довжина зв'язку росте в зворотному порядку:
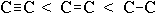 .
.
Характеристики деяких ковалентних зв'язків представлені в таблиці:

Розвантажувальна вправа. Розітріть долоні, щоб у них з'явилося відчуття тепла, складіть їх навхрест, прикладіть до повік, передаючи таким чином їх енергію тепла до очей. Затримайтеся в такому положенні на 30-40 секунд. Після закрийте очі і повільно натискайте на повіки кінчиками пальців. Повторіть 2-3 рази.
Неполярний ковалентний зв'язок
Неполярний (симетричний) ковалентний зв'язок - зв'язок між атомами з практично рівними значеннями електронегативності.
(0 = ∆χ 0,4) і, отже, рівномірним розподілом електронної густини між ядрами атомів.
Наприклад : H - H, F - F, Cl - Cl, C - C.
Зв'язок С-Н у вуглеводнях (наприклад, в СН4) вважається практично неполярним, оскільки
∆χ = 2.5(С) - 2.1(Н) = 0,4.
Слід зазначити, що в ненасичених вуглеводнях ![]() електронегативність Карбону вище і зв'язок С-Н більш полярний (особливо, якщо атом Н зв'язаний з Карбоном, що має потрійний зв'язок:
електронегативність Карбону вище і зв'язок С-Н більш полярний (особливо, якщо атом Н зв'язаний з Карбоном, що має потрійний зв'язок: ![]()
Полярний ковалентний зв'язок
Полярний (несиметричний) ковалентний зв'язок - зв'язок між атомами з різними значеннями електронегативності (0.5 ∆χ 2) і несиметричним розподілом загальної електронної пари.
Електронна густина такого зв'язку зміщена у бік більш електронегативного атома, що приводить до появи на ньому часткового негативного заряду δ- (дельта мінус), а на менш електронегативному атомі - часткового позитивного заряду δ+ (дельта плюс):
C δ+ - Cl δ-, C δ+ - Oδ-, C δ+ - N δ-, O δ- - H δ+, Cδ- - Mg δ+.
Напрям зсуву електронів позначається також стрілкою:
CCl, CО, CN, ОН, CMg.
Чим більше відмінність в значеннях електронегативності зв'язаних атомів, тим вище полярність зв'язку. Між протилежними за знаком частковими зарядами діють додаткові сили притягання. Тому, чим більше полярний зв'язок, тим він міцніше.
Йонний зв'язок
- Хімічний зв'язок, що утворюється в результаті електростатичного притягання йонів, називається йонним зв'язком
Такий зв'язок виникає при великій різниці в значеннях електронегативності зв'язаних атомів (∆χ >2), коли менш електронегативний атом майже повністю віддає свої валентні електрони і перетворюється на катіон, а інший, більш електронегативний атом, ці електрони приєднує і стає аніоном.
Наприклад, в натрій хлориді NaCl різниця значень електронегативності атомів дорівнює:
= 3.0(Cl) - 0.9(Na) = 2.1.
Атом Na (1 електрон на зовнішньому рівні) і атом Cl (7 зовнішніх електронів) перетворюються на йони Na+ і Cl- із завершеними зовнішніми електронними оболонками (по 8 електронів), між якими виникає електростатичне притягання, тобто йонний зв'язок.
Йонний зв'язок не має просторової спрямованості, оскільки кожний йон пов'язаний з певним числом протилежних йонів. Тому речовини з йонним зв'язком не мають молекулярної будови і є твердими речовинами, що утворюють йонні кристалічні гратки, з високими температурами плавлення і кипіння, часто утворюють солі, їх водні розчини електропровідні. Речовин з чисто йонними зв'язками практично не існує.
В органічних сполуках йонні зв'язки зустрічаються досить рідко, оскільки атом Карбону не схильний ні втрачати, ні приєднувати електрони, утворюючи йони.
Органічні речовини класифікують за різними ознаками:
1. За будовою карбонового ланцюга:
лінійні
циклічні
2. За складом:
вуглеводні
оксигеновмісні
галогеновмісні
нітрогеновмісні
3. За наявністю функціональних груп
спирти
карбонові кислоти
амінокислоти та ін.
Класифікація органічних сполук:
|
Група |
Клас |
Особливість |
Загальна |
Приклади |
|
Вуглеводні
|
Алкани |
одинарні зв’язки С – С |
СnН2n+2 |
CН4 - метан |
|
Алкени |
подвійний |
СnН2n |
C2Н4 |
|
|
Алкіни |
потрійний |
СnН2n-2 |
C2Н2 |
|
|
Арени |
ароматичне |
СnН2n-6 |
С6Н6 - бензен |
|
|
Оксигеновміс
ні
|
Спирти |
функціональна група |
R-ОН |
СН3-ОН - метанол |
|
Карбонові |
функціональна група |
R-СООН |
СН3-СООН – етанова |
|
|
Вуглеводи |
функціональні групи |
Сn(Н2О)m |
С6Н12О6 - глюкоза |
|
|
Нітрогено –
вмісні |
Амінокис - |
функціональні групи |
R-СООН |
NН2 –СН -СООН – |
|
Білки |
наявна пептидна |
(R-СОО -) n |
інсулін, |
Закріплення вивченого матеріалу:
- Перші кроки з органічної хімії https://learningapps.org/2136386
-
Вкажіть сполуки, в яких є:
а) тільки ковалентні зв'язки;
б) ковалентні та йонні.
А. СН4
Б. CH3NH2
В. MgF2
Г. CH3ОNa
Відповідь 1: а) сполуки А, Г; б) сполука Б
Відповідь 2: а) сполуки А, Б, В, Г; б) немає
Відповідь 3: а) сполуки А, Б; б) сполуки В, Г
Відповідь 4: а) сполуки А, Б; б) сполука Г
3. Вкажіть молекулу з найбільш полярними зв'язками:
Відповідь 1: CH4
Відповідь 2 : CF4
Відповідь 3: CCl4
Відповідь 4: CBr4
Відповідь 5: CS2
Домашнє завдання:
§2, № 2, 3, 9 с. 25

про публікацію авторської розробки
Додати розробку
