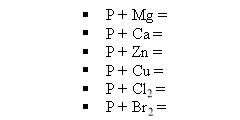Урок "Нітроген і Фосфор"
дати характеристику елементам Нітрогену і Фосфору відповідно до їх положення в періодичній системі і будови атомів; розширити знання студентів з алотропії на прикладі алотропних модифікацій фосфору; розглянути хімічні й фізичні властивості простих речовин, утворених Нітрогеном і Фосфором; систематизувати і доповнити знання студентів про поширення Нітрогену і Фосфору у природі; показати на прикладі елементів V групи взаємозв'язок між будовою атому, положенням елементів у періодичній системі та їхніми фізичними і хімічними властивостями;
Міністерство освіти і науки України
Дрогобицький нафтовий технікум
План – конспект
відкритого заняття з предмету
Х І М І Я
спеціальність 5.092503.02 „Монтаж, обслуговування засобів і
систем автоматизованого технологічного виробництва”
Тема заняття : 2.3 „Нітроген і Фосфор”
Методична мета : розвиток загальнонавчальних умінь студентів – уміння аналізувати,
узагальнювати матеріал, робити висновки з наведених фактів.
Викладач:______________________________ Богак Л.Р.
Дрогобич
|
Тема заняття:
Вид заняття:
Мета заняття:
Міжпредметні зв’язки:
Внутрішні зв’язки:
Забезпечення заняття:
Література:
|
„Нітроген і Фосфор”
Комбінований
Навчальна: дати характеристику елементам Нітрогену і Фосфору відповідно до їх положення в періодичній системі і будови атомів; розширити знання студентів з алотропії на прикладі алотропних модифікацій фосфору; розглянути хімічні й фізичні властивості простих речовин, утворених Нітрогеном і Фосфором; систематизувати і доповнити знання студентів про поширення Нітрогену і Фосфору у природі; показати на прикладі елементів V групи взаємозв’язок між будовою атому, положенням елементів у періодичній системі та їхніми фізичними і хімічними властивостями; Розвиваюча: розвивати інтелектуальні можливості та пізнавальну активність студентів на занятті, формувати в них зацікавленість до вивчення предмету; Виховна: орієнтувати студентів на можливість практичного застосування знань та вмінь з предмету в їх майбутній трудовій діяльності.
Предмети, які забезпечуються: біологія, органічна хімія, основи екології, основи філософських знань, охорона праці
Роздатковий матеріал: роздатковий (ілюстрацій ний) матеріал для студентів
Наочність: демонстрація реакцій, схем, фото за допомогою мультимедійного проектора
В.П. Басов, В.М.Фодіонов Хімія, Навчальний посібник, 4 видання Київ „Каравела”, 2004, 320 с. Н.М.Буринська Хімія 8 клас , Київ „Ірпінь”, 2000, 158с. Н.М.Буринська, Л.П. Величко Хімія 10 клас , Київ „Ірпінь”, 2000, 172с. Н.В.Романова Загальна та неорганічна хімія:Підручник для студентів-Київ; Ірпінь:ВТФ „Перун”, 1998.-480с.
|
ПЛАН ВІДКРИТОГО ЗАНЯТТЯ
|
Предмет : |
Хімія |
|
|
Викладач : |
Богак Л.Р. |
|
|
Тема : |
„Нітроген і Фосфор” |
|
|
Вид заняття : |
Комбінований |
|
|
Мета : |
Навчальна |
дати характеристику елементам Нітрогену і Фосфору відповідно до їх положення в періодичній системі і будови атомів; розширити знання студентів з алотропії на прикладі алотропних модифікацій фосфору; розглянути хімічні й фізичні властивості простих речовин, утворених Нітрогеном і Фосфором; систематизувати і доповнити знання студентів про поширення Нітрогену і Фосфору у природі; показати на прикладі елементів V групи взаємозв’язок між будовою атому, положенням елементів у періодичній системі та їхніми фізичними і хімічними властивостями; |
|
Виховна |
орієнтувати студентів на можливість практичного застосування знань та вмінь з предмету в їх майбутній трудовій діяльності.
|
|
|
Міжпредметні в’язки : |
Предмети, які забезпечуються: біологія, органічна хімія, основи екології, основи філософських знань, охорона праці
|
|
|
Забезпечення заняття : |
Роздатковий матеріал: роздатковий (ілюстрацій ний) матеріал для студентів Наочність: демонстрація реакцій, схем, фото за допомогою мультимедійного проектора
|
|
Х І Д З А Н Я Т Т Я
1 Організаційна частина
2 Повідомлення теми, плану та мети заняття
2.1 Нітроген і Фосфор, їх місце в періодичній системі, будова атомів.
2.2 Азот і фосфор, поширення у природі. Алотропія фосфору.
2.3 Фізичні та хімічні властивості азоту і фосфору.
2.4 Методи добування азоту і фосфору
3 Мотивація навчальної діяльності студентів, постановка проблемних питань
4 Актуалізація опорних знань (буде проведена протягом всього заняття)
5 Вивчення нового матеріалу
- Підведення підсумків заняття
- Домашнє завдання (короткі конспекти лекцій)
ХІД ЗАНЯТТЯ
|
№ п/п |
Елементи заняття |
Зміст питань, що вивчаються; методи і методичні прийоми їх вивчення |
Примітка |
||||||||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
||||||||||||||||||||||||||||
|
1 |
Організаційна частина |
Перевірка присутніх студентів на занятті.
|
|
||||||||||||||||||||||||||||
|
2 |
Повідомлення теми, плану та мети заняття |
Ми продовжуємо вивчати елементи – неметали. Сьогодні ви познайомитесь з елементами V групи головної підгрупи, а саме з Нітрогеном та Фосфором. Отже, тема заняття: „Нітроген і Фосфор” Метою заняття є дати характеристику елементам Нітрогену і Фосфору відповідно до їх положення в періодичній системі і будови атомів; розширити знання з алотропії на прикладі алотропних модифікацій фосфору; розглянути фізичні й хімічні властивості простих речовин, утворених Нітрогеном і Фосфором. План вивчення теми: 1 Положення елементів Нітрогену і Фосфору в ПС, будова атомів та молекул. 2 Азот і Фосфор, поширення у природі. Алотропія фосфору. 3 Фізичні та хімічні властивості азоту і фосфору. 4 Методи добування азоту і фосфору. |
|
||||||||||||||||||||||||||||
|
3 |
Мотивація навчальної діяльності студентів, постановка проблемних питань |
Отже, на сьогоднішній парі ми розглянемо Нітроген і Фосфор – елементи, які мають величезне значення в житті природи і людського суспільства. Нітроген входить до складу багатьох органічних сполук, вивчати які ми будемо в другому семестрі, набуті знання допоможуть при вивченні органічної хімії.
|
|
||||||||||||||||||||||||||||
|
4 |
Актуалізація опорних знань |
Буде проведена протягом всього заняття. |
|
||||||||||||||||||||||||||||
|
5 |
Вивчення нового матеріалу |
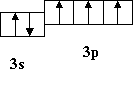
1 Насамперед давайте пригадаємо, які основні структурні одиниці періодичної системи ви знаєте ? Виходячи з положення у періодичній системі хімічних елементів, охарактеризуйте Нітроген і Фосфор. Нітроген і Фосфор знаходяться в V групі періодичної системи, в головній її підгрупі. Нітроген N належить до другого періоду, порядковий номер його 7; Фосфор Р належить до третього періоду, порядковий номер його 15. Питання: Яку інформацію дає порядковий номер, номер періоду та номер групи ? Ця інформація дає можливість записати електронні формули Нітрогену і Фосфору.
N -1s22s22р3 Р - 1s22s22р63s23p3
Питання: Давайте пригадаємо, як змінюються властивості елементів зі збільшенням порядкового номера у періодах та групах ? Металічні властивості у періодах послаблюються, а у підгрупах посилюються. Неметалічні властивості у періодах посилюються, а у підгрупах послаблюються. Нітроген і Фосфор є типовими неметалами однак неметалічні властивості у них менш яскраво виражені, ніж у Оксигену та Сульфуру, Флуору та Хлору.
А так, як Фосфор розташований в групі нижче Нітрогену, у нього неметалічні властивості виражені слабше, ніж у Нітрогену. У атомів Нітрогену і Фосфору на зовнішньому енергетичному рівні є п’ять електронів: два спарених s – електрони і три неспарених р – електрони. Питання: Пригадайте, як називають неспарені електрони? Охарактеризуйте збуджений стан атома.
Виходячи з графічної будови атомів Нітрогену і Фосфору проаналізуйте, чи буде характерний збуджений стан для їх атомів.
Збуджений стан атома можливий тільки для Фосфору й інших елементів V групи, крім Нітрогену. Хімія Нітрогену, на відміну від хімії Фосфору, досить своєрідна. Це пояснюється тим, що атом Нітрогену не здатний переходити в збуджений стан. Розпаровування електронної пари 2s2 – енергетично неможливий процес, так як електрону немає місця на подальших атомних орбіталях атома Нітрогену: р–АО атома Нітрогену зайняті, d-АО – енергетично заборонені. А в атомі Фосфору на зовнішньому енергетичному рівні є вільні d-орбіталі, що дає йому можливість перейти в збуджений стан:
Основний стан атома Фосфору Збуджений стан атома Фосфору
Виходячи із будови атома Нітрогену і Фосфору, проаналізуйте, які ступені окиснення будуть їм найбільш характерні. Питання: Дайте визначення ступеню окиснення ? Якщо атом Нітрогену відтягує 3 електрони від атома менш електронегативного елемента, його ступінь окиснення становить -3. У сполуках з більш електронегативним елементом ступінь окиснення Нітрогену позитивна. Значення ступеня окиснення Нітрогену (+1, +2, +3, +4, +5) залежить від того, скільки валентних електронів Нітрогену (1,2,3,4 або всі 5) відтягуються до атомів більш електронегативного елемента. Нітроген N0
N-3 N+1,N+2,N +3,N+4,N+5
Ступені окиснення: -3, 0,+1, +2, +3, +4, +5
У сполуках з менш електронегативними елементами атом Фосфору відтягує на себе три електрони і його ступінь окиснення дорівнює -3. Якщо атом Фосфору поєднується з більш електронегативним атомом, то він може віддавати три або п’ять електронів. Тоді його ступені окиснення будуть дорівнювати +3 і +5. Фосфор Р0
Р-3 Р+3, Р+5
Ступені окиснення: -3, 0, +3, +5
Найбільш характерні ступені окиснення N і Р та сполуки, які їм відповідають
2 Елемент Нітроген займає п’яте місце за розповсюдженістю у Всесвіті: з кожних 100 000 атомів – 15 є атомами Нітрогену. Але за розповсюдженістю на Землі Нітроген знаходиться в кінці другої десятки елементів (у земній корі Нітрогену – 0,04%, основна кількість Нітрогену – знаходиться у атмосфері – 78 об.%). З курсу біології ви знаєте, що Нітроген належить до життєво важливих хімічних елементів. Він входить до складу білкових речовин, а також – до складу багатьох інших органічних сполук, у тому числі й хлорофілу. Коли не вистачає Нітрогену, ріст рослин затримується, листя поступово жовтіє і процес фотосинтезу припиняється. Сполуки Нітрогену в невеликих кількостях містяться в грунті. Нітроген у природі зустрічається у вільному стані, як газоподібний азот.
Д. Резерфорд
А.Лавуазьє Сполуку, без якої немає життя, назвали „безжиттєвою”, „отруйним повітрям”. Без азоту дійсно життя неможливе хоча б тому, що він розбавляє кисень повітря, бо в чистому кисні життя також неможливе, як в чистому азоті. Крім того, ми вже згадували, що Нітроген входить до складу білків. З курсу біології вам також відомо, що із білкових речовин побудовані такі важливі частини клітин як протоплазма і ядро. Без білка немає життя, а без Нітрогену немає білка. Один елемент Нітроген – це смерть і життя. Навіть у назві проявилась унікальність елементу № 7.
Властивості речовини визначаються її будовою. Розглянувши будову молекули азоту, ми зможемо пояснити чому азот погано розчинний у воді, чому за звичайних умов є газом, зможемо спрогнозувати його хімічні властивості. Молекула азоту двохатомна N2. Атоми Нітрогену об’єднуються один з одним за допомогою трьох електронних пар і утворюють міцний потрійний зв’язок.
Молекула азоту утворена однаковими атомами. Питання: Який вид хімічного зв’язку в молекулі азоту? Питання: Який зв’язок називають ковалентним неполярним?
Ми розглянули будову молекули азоту і тепер ви маєте можливість дати відповідь на поставлені проблемні питання: чому азот погано розчинний у воді, чому за звичайних умов є газом, а також азот – хімічно активна чи пасивна речовина ? Отже, молекула азоту неполярна. Саме тому взаємодія між молекулами слабка, вона не може перешкодити їхньому хаотичному рухові. Цим пояснюється газуватий стан азоту за звичайних умов і це є причиною того, що азот зріджується і твердне за дуже низьких температур. (Дійсно, повітря в Антарктиді не зріджується саме по собі, хоча температури там бувають до -80оС) Неполярністю молекул азоту пояснюється його низька розчинність у воді.
Х.Бранд
Під час одного з дослідів Бранд випарив сечу, залишок змішав з вугіллям та піском і продовжив випарювати. Невдовзі у колбі утворилася речовина, що світилася у темряві. Це був фосфор (фосфор - від грецького світлоносний). Фосфор досить розповсюджений елемент в природі, на його долю припадає 0,093% від загальної маси земної кори (13 місце серед всіх елементів). У вільному стані фосфор не зустрічається в природі. Розглянувши будову молекули фосфору ви зможете пояснити, чому фосфор на відміну від азоту у вільному стані не зустрічається, а також спробуєте передбачити його хімічні властивості.
Фосфор входить до складу апатитів і фосфоритів. З курсу біології мабуть відомо, що сполуки Фосфору входять до кісткової, м’язової і нервової тканин людини і тварин. У скелеті Фосфор міститься у вигляді фосфату кальцію. В тілі людини на долю Фосфору припадає 1,5 кг у вигляді фосфату кальцію. Видатний геохімік О.Є.Ферсман назвав його „елементом життя і думки”. Хімічний елемент Фосфор на відміну від Нітрогену утворює кілька простих речовин, які помітно різняться за властивостями.
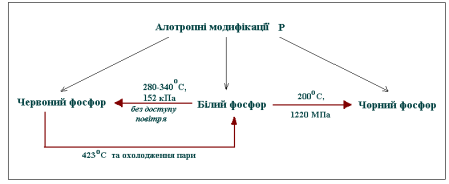
Питання: Давайте пригадаємо, як називається явище існування декількох простих речовин, утворених одним елементом ? Назвіть причини існування різних алотропних форм ?
Фосфор утворює три алотропні модифікації – білий, червоний і чорний.
Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Білий фосфор – надзвичайно отруйна речовина, навіть у малих дозах (50 мг) діє смертельно! Саме тому необхідно дотримуватись всіх правил техніки безпеки при роботі з білим фосфором. Ви пам’ятаєте Ожидів. Грубе порушення правил транспортування небезпечних речовин призвело до аварії – горів білий фосфор, це екологічна катастрофа з непрогнозованими наслідками.
без запаху, не отруйний, на повітрі окиснюється повільно, у темряві не світиться, загорається лише при 260оС. Легко вбирає вологу, але у воді не розчиняється. Під час нагрівання без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор.
3 Хімічні властивості азоту
Як вже згадувалось раніше, молекула азоту складається з двох атомів, зв’язаних трьома парами спільних електронів. Зв’язок атомів у молекулі азоту значно міцніший, ніж у молекулі кисню й тим більше фтору. А в результаті перебігу певної хімічної реакції руйнуються старі зв’язки і утворюються нові. Зрозуміло, що потрібно витратити велику кількість енергії на руйнування потрійного зв’язку. Саме тому молекулярний азот - хімічно інертна речовина і вступає у реакції при високій температурі і/або в присутності каталізатора. І це чудово, інакше нас не було б на цій голубій планеті, і планета можливо не була б голубою. У цьому ви переконаєтесь через декілька хвилин.
Якщо в посуд, заповнений азотом, внести запалену скибку, полум’я миттєво згасне, так ніби скибку опустили в склянку з водою. Азот не підтримує горіння і сам не горить.
1 Взаємодія з киснем: Азот сполучається з киснем при дуже високих температурах (біля 3000оС) N2 + O2 2NO 2 Взаємодія з воднем: З воднем азот взаємодіє у присутності каталізатора (наприклад, залізо, активоване оксидами кальцію і алюмінію) при високому тиску (300 ат) і температурі (500оС): N2 + 3H2 2NH3 3 Взаємодія з металами: При кімнатній температурі азот реагує тільки з літієм: N2 + 6Li = 2Li3N З іншими металами він реагує при високих температурах: 2Al + N2 = 2 AlN 3Mg + N2 = Mg3N2 Речовини, що утворюються в результаті цих реакцій, називаються нітридами. А тепер уявімо собі, що азот є хімічно активною речовиною і взаємодіяв би з киснем за звичайних умов. Повітря було б бурого кольору (завдяки диоксиду Нітрогену – який із-за свого забарвлення називають „бурим газом”) і надзвичайно отруйним для всього живого (за винятком N2O, всі оксиди Нітрогену є отруйними). Мало того, вдихаючи N2O – який називають „веселильний газ”, ми постійно б перебували у стані сп’яніння.
Хімічні властивості фосфору
Радіус атома Фосфору більший за радіус атома Нітрогену. Тому атом Фосфору гірше утримує свої валентні електрони і слабше притягує електрони, яких йому не вистачає для завершення зовнішнього рівня. Фосфор виявляє як окисні, так і відновні властивості. З усіх алотропних модифікацій найбільш активним є білий фосфор.
1 Взаємодія з киснем:
Білий фосфор самозаймається, а червоний горить при підпалюванні. При недостатності кисню утворюється Фосфор (ІІІ) оксид - дуже отруйна речовина: 4Р + 3О2 = 2Р2О3
При надлишку кисню утворюється Фосфор (V) оксид :
4Р + 3О2 = 2Р2О5 2 Взаємодія з металами: При нагріванні фосфор реагує з металами утворюючи фосфіди: 3Са + 2Р = Са3Р2 – кальцій фосфід
З воднем фосфор практично не взаємодіє.
4
Добування азоту. У промисловості азот добувають ректифікацією зрідженого повітря. Азот відокремлюють від менш леткого кисню (температура кипіння азоту – 196, кисню – 183оС). Добутий таким чином азот містить домішки. Чистий азот можна добути у лабораторних умовах, термічним розкладанням нітриту амонію: NH4NO2 = N2 + 2H2O
Добування фосфору. Фосфор добувають з фосфоритів. Для цього подрібнений фосфорит змішують з піском і коксом, суміш нагрівають в електропечах до 1400-1500оС без доступу повітря.
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Фосфор, що утворюється внаслідок реакції, переходить у пару, яка конденсується у приймачі під водою.
|
Актуалізація опорних знань
Актуалізація опорних знань
Актуалізація опорних знань
Актуалізація опорних знань
Проблемне питання
Мутильмедійний проектор
Проблемне питання
Актуалізація опорних знань
Мутильмедійний проектор
Мутильмедійний проектор
Мутильмедійний проектор
Міжпредметні зв’язки
Міжпредметні зв’язки
Проблемні питання
Мутильмедійний проектор
Актуалізація опорних знань
Міжпредметні зв’язки
Мультимедійний проектор
Проблемне питання
Міжпредметні зв’язки
Актуалізація опорних знань
Мутильмедійний проектор
Міжпредметні зв’язки
Міжпредметні зв’язки
Мультимедійний проектор
Мультимедійний проектор
Мультимедійний проектор
Мультимедійний проектор
Мультимедійний проектор
|
||||||||||||||||||||||||||||
|
6 |
Підведення підсумків |
Підсумовую результати пари, даю оцінку роботі студентів.
|
|
||||||||||||||||||||||||||||
|
7 |
Домашнє завдання |
2 Застосування азоту і фосфору:
? ? ? ?
Р N2
? ? ? ? ? ?
|
|
Екологічні властивості азоту:
Азот – „безжиттєвий елемент” – на справді елемент, що дає життя. Розбавляючи кисень, він дає можливість реакціям окислення органічних речовин протікати порівняно повільно і зупинятися на проміжних ступенях окиснення.
В той же час азот може бути носієм просто небезпечного. Наприклад, азот спокійно може зруйнувати дах будівлі під час буревію. Так як повітряні маси - і буревій, і мусон, і просто вітер – це все на ¾ азот. І екологічна хімія азоту перетворюється в екологію повітря, а це вже одна з тем предмету Основи екології, який ви будете вивчати на третьому курсі.
Застосування азоту.
Азот у великих кількостях використовується для добування аміаку і для наповнення електроламп (інертне середовище). Ним азотують поверхню сталевих виробів, тобто насичують поверхню азотом при високій температурі. У результаті утворюються нітриди заліза, що надають сталі великої твердості. Азот застосовують у виробництві мінеральних добрив.
Застосування фосфору.
Білий фосфор широкого застосування не має. Його використовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину, також для утворення димових завіс.
Червоний фосфор використовується для виробництва сірників. Крім виробництва сірників, фосфор застосовують у металургії. Використовують його і для виготовлення напівпровідників, фосфорорганічних препаратів – засобів знищення комах – шкідників сільськогосподарських рослин.

про публікацію авторської розробки
Додати розробку