Урок "Окисно-відновні реакції. Поняття про метод електронного балансу."
Тема: Окисно-відновні реакції. Поняття про метод електронного балансу.
Мета:
формування предметних компетентностей:
- поглибити знання про типи хімічних реакцій;
- розкрити суть окисно-відновних реакцій, процесів окиснення та відновлення;
- навчити складати рівняння окисно-відновних реакцій методом електронного балансу;
- удосконалювати спеціальні вміння роботи з підручником, схемами;
- розвивати пам’ять, увагу, мислення;
- виховувати почуття необхідності систематичної підготовки до занять;
формування ключових компетентностей:
- спілкування державною мовою;
- основні компетентності у природничих науках і технологіях;
- ініціативність і підприємливість;
- математична компетентність.
Тип уроку: комбінований.
Обладнання: індивідуальні картки (тести), блок-схема “класифікація хімічних реакцій”, алгоритм “Складання ОВР методом електронного балансу ”.
Форми роботи: індивідуальна робота, бесіда, розповідь, пояснення, розв’язання вправ.
Хід уроку.
І. Організаційний момент.
ІІ. Створення позитивної психологічної аури.
Здається, що в цьому житті немає нічого вічного. Пам’ятаєте: “Все тече, все змінюється…”? Проте на зміну зимі завжди приходить весна. Ніч, якою б довгою не була, скінчається, і настане ранок. Доки існують люди, вони будуть прагнути щастя і кращої долі. Нехай усі наші надії збудуться.
Я бажаю, щоб у наших домівках запанувало порозуміння, а в наших серцях оселився вогник надії і сяяв нам протягом усього життя, особливо сьогодні на уроці.
ІІІ. Актуалізація опорних знань.
Тестові завдання для кожного учня.
І варіант
1. Ступінь окиснення Оксигену дорівнює:
а) +1 б) +2 в) -2 г) 0?
2. Ступінь окиснення Феруму у сполуці Fe2O3 дорівнює:
а) +1 б) +3 в) 0 г) +2?
3. Ступінь окиснення лужних металів дорівнює:
а) +2 б) +1 в) -1 г) 0?
4. Ступінь окиснення Нітрогену у сполуці Ca3N2 дорівнює:
а) -3 б) 0 в) -2 г) +3?
5. Ступінь окиснення Оксисену у пероксидах дорівнює:
а) -2 б) 0 в) -1 г) +1?
6. Ступінь окиснення Фосфору у сполуці Ca3(PO4)2 дорівнює:
а) +5 б) +3 в) -1 г) -3?
ІІ варіант
1. Ступінь окиснення Фтору дорівнює:
а) -2 б) +1 в) 0 г) -1?
2. Ступінь окиснення Алюмінію у сполуці AL2O3 дорівнює:
а) +2 б) -3 в) +3 г) +4?
3. Ступінь окиснення барію у сполуках дорівнює:
а) +1 б) -2 в) +2 г) -1?
4. Ступінь окиснення Карбону у сполуці Al4C3 дорівнює:
а) +4 б) -4 в) +3 г) -3?
5. Ступінь окиснення Гідрогену дорівнює:
а) 0 б) +1 в) -1 г) -2?
6. Ступінь окиснення Нітрогену у сполуці Ca(NO3)2 дорівнює:
а) +5 б) +4 в) +3 г) +2?
Обмінятися своїми відповідям з сусідом по парті, які перевіряють роботи по шаблону. Правильна відповідь 2 бали, неточна – 1 бал, неправильна – 0 б.
ІV. Мотивація навчальної діяльності учнів, повідомлення теми, мети і завдань уроку.
За допомогою учнів складаємо опорну схему класифікація хімічних реакцій:
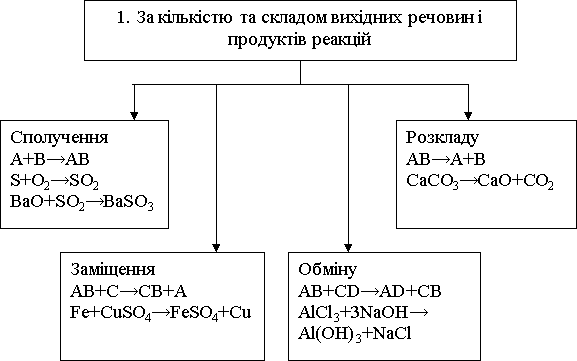



Оголошення теми, мети уроку.
Девізом нашого уроку я пропоную взяти китайську мудрість:
Скажи мені, і я забуду
Покажи мені, і я запам’ятаю
Дай можливість діяти самому, і я навчусь.
V. Вивчення нового матеріалу.
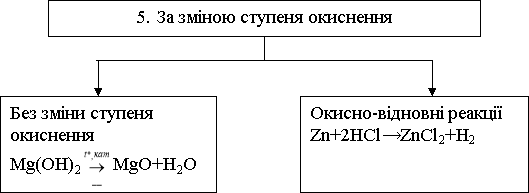
Ми згадали різні класифікації хімічних реакцій. Серед різноманітних хімічних реакцій можна виділити такі, що відбуваються із зміною ступенів окиснення атомів елементів, які входять до складу реагуючих речовин. За цією ознакою усі хімічні реакції поділяються на два типи.
-
 Реакції, що відбуваються без зміни ступенів окиснення атомів, які входять до складу реагуючих речовин.
Реакції, що відбуваються без зміни ступенів окиснення атомів, які входять до складу реагуючих речовин.
- Реакції, що відбуваються зі зміною ступенів окиснення атомів, які входять до складу реагуючих речовин.
Реакції, які відбуваються із зміною ступенів окиснення атомів, що входять до складу реагуючих речовин, називають окисно-відновними.
Зміна ступенів окиснення атомів пояснюється переходом (або зміщенням) електронів від одних атомів, молекул, йонів до інших.
Процес віддавання електронів атомом елемента називають окисненням, а процес їх приєднання —відновленням.
Мg + H2SO4 → MgSO4 + H2
У наведеному прикладі Магній до реакції мав ступінь окиснення 0 (нуль) (як завжди у простих речовинах), а після реакції +2. Отже, кожний атом Магнію віддав 2 електрони, відбувся процес окиснення. Атоми Гідрогену до реакції мали ступінь окиснення +1, а після реакції 0 (нуль). Отже, кожний атом Гідрогену приєднав по одному електрону, тобто відбувся процес відновлення.
Ці процеси можна подати такими схема:
відновник Mg - 2е → Mg (процес окиснення);
окисник 2Н + 2е → 2Н → Н2 (процес відновлення).
Речовини, які під час хімічної реакції віддають електрони, називаються відновниками.
У наведеному приклад Магній—відновник. Віддаючи електрони, він окиснюється. А атоми Гідрогену із ступенем окиснення +1 у складі сульфатної (сірчаної) кислоти приєднуються електрони й, отже, відновлюються до газоподібного водню Н2.
Речовини, які під час хімічної реакції приєднують електрони, називаються окисниками.
Отже, окисник у процесі реакції відновлюється, а відновник — окиснюється.
Коефіцієнти в окисно-відновних реакціях зручно підбирати за методом електронного балансу. В його основі лежить порівняння ступенів окиснення атомів у вихідних і кінцевих речовинах. Обчислюючи коефіцієнти, слід пам'ятати, що число електронів, які віддав відновник, має дорівнювати числу електронів, які приєднав окисник.
VI. Тренувальні вправи.
Серед реакцій визначте, які відносяться до окисно-відновних реакцій та урівняйте їх методом електронного балансу.
а) Al+O2→Al2O3
б) NaOH+HCl→NaCl+H2O
в) Mg+H3PO4→Mg3(PO4)2+H2
г) HI+H2SO4→H2S+H2O+I2
VII. Домашнє завдання.
Вивчити §16


про публікацію авторської розробки
Додати розробку
