Урок з хімії на тему:"Ковалентний зв’язок,його утворення.Полярний і неполярний ковалентний зв’язок"
узагальнити та поглибити знання про хімічний зв'язок, механізм утворення ковалентного полярного та неполярного зв'язків; повторити характеристики ковалентного зв'язку: довжина, енергія, полярність, кратність, насиченість, направленість у просторі, гібридизація.повторити поняття катіон, аніон, відновлення, окиснення, йонна сполука; виховувати культуру наукового мислення.
Тип уроку: узагальнення та поглиблення знань.
Тема: Ковалентний зв’язок,його утворення.Полярний і неполярний ковалентний зв’язок
Мета: узагальнити та поглибити знання про хімічний зв’язок, механізм утворення ковалентного полярного та неполярного зв’язків; повторити характеристики ковалентного зв’язку: довжина, енергія, полярність, кратність, насиченість, направленість у просторі, гібридизація.повторити поняття катіон, аніон, відновлення, окиснення, йонна сполука; виховувати культуру наукового мислення.
Тип уроку: узагальнення та поглиблення знань.
Хід уроку:
І. Організація класу.
ІІ. Оголошення теми і мети уроку.
ІІІ. Мотивація навчальної діяльності.
Вивчивши будову атома ми з’ясували, що у атома на зовнішньому енергетичному рівні може міститися від 1 до 8 електронів (т.я. кількість зовнішніх валентних електронів показує № групи, а груп в періодичній системі 8). Якщо зовнішній шар заповнений повністю електронами, то його називають завершеним. Але таких атомів мало: із 110 – 8, їх називають інертними, або благородними газами. Зовнішні рівні атомів інших елементів незавершені і завершуються коли атоми з’єднуються утворюючи молекули чи кристали простих чи складних сполук. Взаємодію між атомами в результаті якої утворюється хімічно стійка сполука називають хімічним зв’язком. Відомі 4 типи хімічного зв’язку: ковалентний, йонний, металічний, водневий. Сьогодні ми повторимо їх основні характеристики.
ІV. Актуалізація опорних знань.
Записати електронні та графічно-електронні формули атомів: Cl, N, C, O, H.
V. Повторення основних фактів і понять.
1. Механізм утворення ковалентного зв’язку(учні повторюють поняття ковалентний полярний зв’язок, ковалентний неполярний зв’язок, електронегативність, електронна формула, структурна формула, молекулярна формула, кратність зв’язку: одинарний, подвійний і потрійниц)
На прикладі будови сполук хлору, азоту, карбон (ІІ) оксиду, метану пригадати механізм утворення ковалентного зв’язку.
Неподільна пара електронів
Валентні електрони
Спільна ( або подільна) ел-на пара Кратність зв’язку (одинарний, подвійний, потрійний)
Електронна формула Структурна формула Молекулярна формула
Електронегативність
Тип хімічного зв’язку
Валентні електрони- електрони, які беруть участь в утворенні хімічних зв’язків. Валентними можуть бути як неспарені електрони, так і спарені електрони, якщо атом знаходиться в збудженому стані.
Ковалентний зв’язок – це зв’язок утворений спільною електронною парою.
Характеристики ковалентного зв’язку
Якщо між атомами виник один ковалентний зв’язок, то він називається одинарним (одна спільна електронна пара), два – подвійним (дві спільні електронні пари), три – потрійним (три спільні електронні пари).
Одинарний зв’язок позначають однією рискою, подвійний – двома, потрійний – трьома. Цю характеристику називають кратність зв’язку.
Чим більша кратність зв’язку тим менша довжина.
Довжина зв’язку – це відстань між ядрами атомів, які утворюють зв’язок (одиниця вимірювання 1нм= 10-9м).
Кратність зв’язку впливає і на його енергію.
Енергія зв’язку – це кількість енергії яку потрібно витратити, щоб розірвати зв’язок. З підвищенням кратності енергія зростає.
Ковалентний зв’язок
(зв’язок утворений спільними електронними парами)
Неполярний Полярний
(спільна електронна пара (спільна електронна пара
розміщена по центру зміщена в бік атома
відносно ядер двох атомів) з більшою електронегативністю)
неМе+неМе неМе+неМе
прості речовини складні речовини
різниця електронегативностей = 0 різниця електронегативностей < 1,7
Ковалентний неполярний зв'язок.
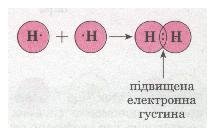
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
Мал. 23. Схема утворення хімічного зв'язку між атомами.
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
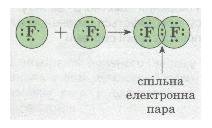
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:
Мал. 24. Структурна формула водню.
У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
Мал. 25. Електронна пара.
У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
Хімічний зв'язок, який утворюється за допомогою спільних електронних пар, називають ковалентним зв'язком.
Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами.
У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, оскільки в них однакова електронегативність. Так, у молекулах Н2, О2, F2, Сl2існує неполярний ковалентний зв'язок.
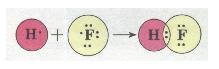
Ковалентний полярний зв'язок. Якщо атоми, що взаємодіють, мають різну електронегативність (атоми різних неметалів), то спільна електронна пара зміщується до атома з більшою електроне-гативністю. У цьому разі виникає полярний ковалентний зв'язок. Наприклад, у молекулі флуороводню HF зв'язок ковалентний полярний:
Мал. 27. Полярний ковалентний зв'язок.
У результаті зміщення електронної пари в молекулі HF (стрілка показує напрямок зміщення) молекула стає полярною, виникає диполь.
Диполь — це система з двох зарядів, однакових за величиною і протилежних за знаком.
Вважають, що атом, до якого зміщена електронна пара, набуває деякого негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду:
![]()
(гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).
Полярний ковалентний зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV) оксиду С02 електронні пари зміщуються до Оксигену як до більш електронегативного елемента. Але диполь не виникає, бо молекула симетрична.
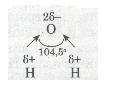
Молекули води Н2О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність структури і полярність молекул води:
Кутові молекули сірководню H2S, пірамідальні молекули амоніаку NH3 також мають несиметричну структуру, тому вони полярні (мал. 28).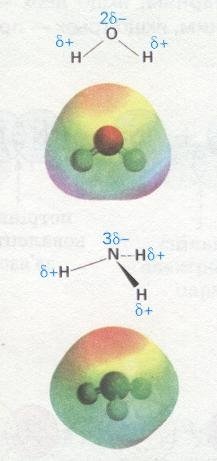
Мал. 28. Полярні молекули води та амоніаку
За кількістю утворених ковалентних зв'язків визначають валентність елемента. Валентність (від лат. valentia — сила) — це здатність атома приєднувати певне число інших атомів. Ця здатність залежить від кількості неспарених електронів атома в основному або збудженому стані, що беруть участь в утворенні спільних електронних пар з електронами інших атомів. Величина валентності визначається, як правило, числом ковалентних зв'язків, які даний атом утворює з іншими атомами. Саме тому валентність не має знака — ні плюс, ні мінус. Якщо атом Гідрогену утворює один ковалентний зв'язок, то він одновалентний, якщо атом Карбону утворює чотири зв'язки, то він — чотиривалентний.
Узагальнення вивченого матеріалу
Хімічний зв'язок — це сила, яка утримує атоми (будь-які частинки) в хімічній сполуці. Вона виникає внаслідок взаємодії ядер і електронів. Хімічний зв'язок, що зумовлений утворенням спільних електронних пар, називається ковалентним. Він може бути полярним і неполярним залежно від того, які атоми з'єднуються: якщо однакові — неполярний, якщо різні за електронегативністю — полярний. Залежно від кількості спільних електронних пар, ковалентний зв'язок буває одинарним, подвійним, потрійним.
Спільні електронні пари утворюються внаслідок об'єднання неспаре-их валентних електронів атомів неметалів.
За кількістю неспарених електронів атома або кількістю утворених ковалентних зв'язків визначають валентність елемента. У результаті утворення хімічного зв'язку атоми набувають стійкого завершеного зовнішнього енергетичного рівня.
Завдання для самоконтролю
1. Як ти розумієш зміст поняття «хімічний зв'язок»? За рахунок чого він виникає?
2. Як утворюється ковалентний зв'язок? Які види ковалентного зв'язку ти знаєш? Чим вони подібні й чим відрізняються один від одного? Відповідь ілюструй прикладами.
3. В яких речовинах існує лише неполярний ковалентний зв'язок? Чому?
4. Чому молекули інертних газів, на відміну від усіх інших неметалів, у вільному стані одноатомні?
5. Напиши електронну і структурну формули гідроген пероксиду Н2О2. Обчисли, скільки електронів міститься на зовнішньому енергетичному рівні атома Оксигену, скільки хімічних зв'язків у цій молекулі. Визнач тип кожного хімічного зв'язку.
6. Намалюй схему перекривання: а) s-електронних хмар двох атомів; б) s-електронної хмари одного атома і р-електронної хмари іншого атома (за будь-якою з осей х, у, z).
7. Наведи електронну конфігурацію атома Оксигену і схему розподілу електронів за орбіталями зовнішнього енергетичного рівня атома. Зроби висновок, скільки електронів атома Оксигену можуть брати участь в утворенні ковалентних зв'язків з атомами Гідрогену?
8. Напиши електронні й структурні формули хлору СІ2, сірководню H2S, амоніаку NH3.
9. На підставі будови атомів Сульфуру й Гідрогену, поясни склад і будову молекули гідроген сульфіду H2S.
Підбиття підсумків уроку
Домашнє завдання
10*. Неполярні молекули у речовини
(а) НСІ; (в) NH3;
(б) CF4; (г) H2S.
11*. Прикладом неполярної молекули, що містить полярний ковалентний зв'язок, є
(а) N2; (в) NH3;
(б) Н2О; (г) ССІ4.
12*. Під час утворення молекули НСІ перекриваються орбіталі типу (а) pip; (в) sis; б) sip; (r)ofip.

про публікацію авторської розробки
Додати розробку