Урок Фізика 9 кл Тема уроку: «Історія вивчення атома. Ядерна модель атома. Склад атомного ядра»
Сокотнюк Оксана Вікторівна
Фізика 9 кл
Тема уроку: «Історія вивчення атома. Ядерна модель атома. Склад атомного ядра»
Освітньо – виховні завдання теми: створити комфортні умови для навчання, за яких кожен учень відчуває свою успішність, інтелектуальну спроможність, самостійність.
Навчальна мета:
1.Дати учням уявлення про будову атома.
2. Познайомити їх із планетарною моделлю атома Резерфорда.
3. Навчитись визначати склад атомного ядра
4. Навчитись відрізняти один від одного атоми різних хімічних елементів.
Розвиваюча мета:
- Розвивати логічне мислення учнів через проведення таких операцій, як аналіз, порівняння, систематизація.
- Розвивати мовну і слухову пам’ять.
- Підвищувати стилістичну культуру мовлення.
- Розвивати творчу уяву.
- Розвивати вміння і навички правильного користування комп’ютером.
Виховна мета:
- Виховувати в учнів доброчесність, самостійність, мислення, справедливість, доброзичливість, гуманність, повагу до людей.
- Виховувати в учнів старанність, наполегливість, бажання творчо працювати.
- Виховувати зацікавленість до історії розвитку промисловості Криворіжжя
Обладнання: таблиця «Періодична система хімічних елементів Менделєєва», картки , комп’ютери, телевізор, плакат для проведення вправи « Трейлер»
Міжпредметні зв’язки: хімія, інформатика, математика
Тип уроку: Урок вивчення нового матеріалу.
Базові поняття: атом, модель Томсона, планетарна модель атома, протон, нейтрон, електрон.
Інтерактивні методи:
- Метод « Трейлер»
- Вправа « Асоціативний кущ»
- Методика « Світове кафе» (групова форма роботи)
- Різнорівневе домашнє завдання.
- Випереджальне домашнє завдання.
Діджитал інструменти: mentimeter, wordwall , coggle, phet.colorado, padlet, kahoot
МЕТОДИ, ФОРМИ І ПРИЙОМИ НАВЧАННЯ
|
МЕТОДИ |
ФОРМИ |
ПРИЙОМИ |
|
1.Інформаційно- рецептивний |
Розповідь-пояснення, бесіда, повідомлення учнів, ТЗН |
Виклад інформації, пояснення, активізація уваги та мислення, прийоми запам’ятовування,
|
|
2.Репродуктивний |
наочні і практичні методи, |
конкретизація і закріплення вже набутих знань |
|
3.Проблемно- пошуковий |
евристична бесіда |
активізація уваги та мислення, різноманітна самостійна робота учнів |
|
4.Навчально – дослідницький |
самостійна творча (дослід- ницька)робота учнів на здобуття та розширення знань |
активізація уваги та мислення, здобуття нових знань у процесі самостійної роботи учнів, формування висновків |
Структура уроку:
І. Організаційна частина.
ІІ. Активізація пізнавальної діяльності учнів.
ІІІ. Актуалізація опорних знань, вивчення нового матеріалу.
ІV. Фізкультхвилинка
V. Закріплення.
VІ. Підбиття підсумків уроку.
VІІ. Домашнє завдання.
ХІД УРОКУ
1. Організаційна частина.
Історія фізичної науки налічує майже 2500 років, але тільки минулого століття фізики перетворилися з поважних викладачів і кабінетних учених на консультантів урядів. Кількість фахівців – фізиків стрімко зростає. Потрібні такі науковці і нашому місту. Металургія — це наука про одержання металів з руд або речовин, які містять метали, і про надання металевим сплавам необхідних властивостей. Металургія ґрунтується на досягненнях фізичної хімії, фізики, металургійної теплотехніки, електротехніки, електроніки, кібернетики, економіки, на теорії металургійних процесів, автоматизації виробництва й керування ним, а також, на космічних технологіях.
А щоб розуміти технологію цих процесів, сьогодні на уроці ми зробимо дуже важливий крок у вивченні фізики, бо зануримося у мікросвіт, світ АТОМА.
Сподіваюся, що після вивчення цієї теми ви краще будете розуміти той дивовижний світ, який нас оточує.
Епіграф нашого уроку:
Від абстрактного мислення до наукового експерименту і від нього до практики – такий шлях розвитку науки.
Давайте з’ясуємо, на скільки ви відчуваєте себе науковцем .
Поставте мітку на шкалі на тому рівні, який відповідає, на вашу думку, рівню вашої « науковості».( Метод « Трейлер»)
![]()
![]()
![]()
![]()
![]()
![]()



( Проаналізувати результати)
2. Активізація пізнавальної діяльності учнів.
Вправа « Асоціації»
Пропоную учням назвати слова - асоціації до слова НАУКА?
( Для візуалізації результатів створюємо « Хмаринку слів» у програмі mentimeter)
![]() (https://www.mentimeter.com/s/d5576cb26460569d04dfa0972e98206e/7c548618b592/edit)
(https://www.mentimeter.com/s/d5576cb26460569d04dfa0972e98206e/7c548618b592/edit)

3. Актуалізація опорних знань, вивчення нового матеріалу.
3.1 Історія вивчення атома. Ядерна модель атома
На минулому уроці ви отримали «випереджальне домашнє завдання» ознайомитися з теоріями будови атома. Матеріали попередніх уроків фізики та хімії вам також стали у пригоді. Отже….
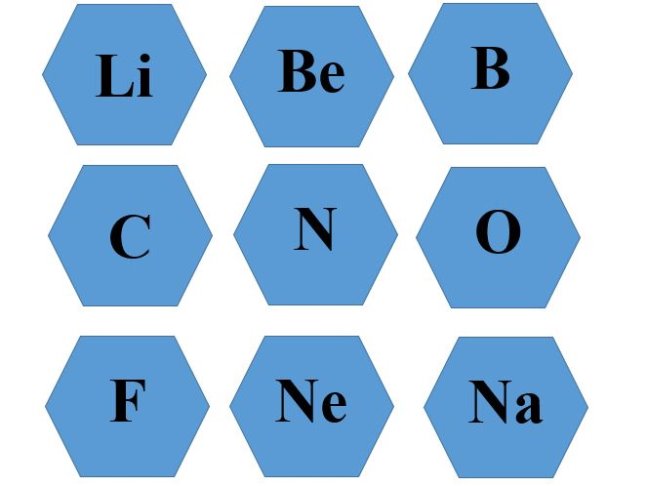
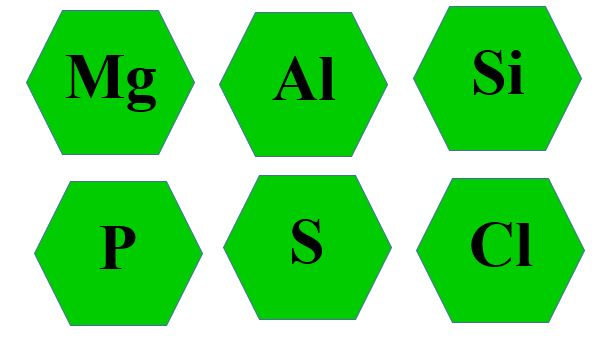
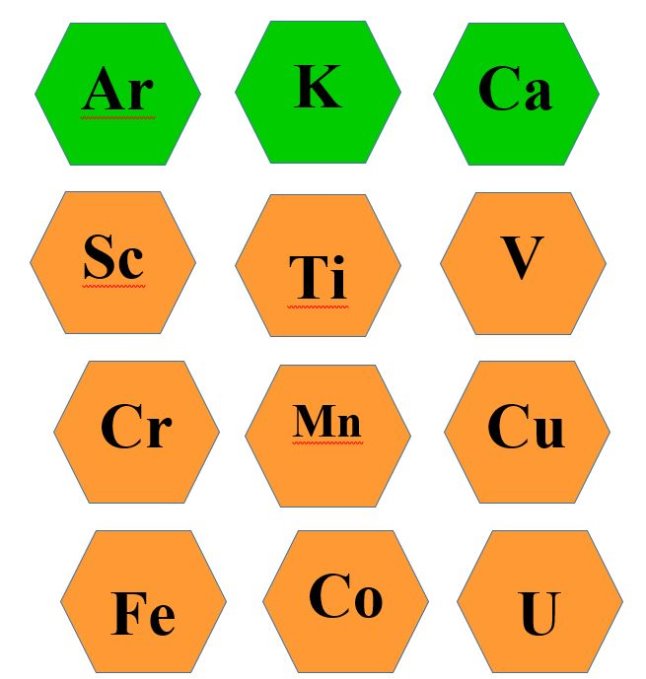
Прошу вас обрати собі хімічний елемент, який вам сподобався. Ви мабуть звернули увагу , що вони відрізняються кольорами. ( Додаток 1)
Скажіть , які хімічні елементи формують основи промисловості нашого міста?
- Літій, Карбон, Оксиген, Сульфур, Ферум, Селен, Уран. А чому залізо?
А чи знали ви, що Сталь — це сплав заліза з вуглецем. Коли рідке
залізо трансформується в сталь, то температура досягає 1300-1500 градусів за Цельсієм (і це більше, ніж температура вулканічної лави).
Про історію виникнення сталі розповідають чудову легенду: начебто перше залізо впало з неба у вигляді метеорита, з якого люди навчилися виготовляти зброю та прикраси. Найдавніший предмет зі сталі — сталевий ніж —
датується XI століттям до нашої ери, його було знайдено на Кіпрі.
Перші ж згадки про спосіб виготовлення заліза — сиродутний процес — датуються другим тисячоліттям до нашої ери. Саме залізо спочатку нагадувало тісто, і його багато разів кували вручну сильними ударами молота. Для масового виробництва заліза в 1864 році французький інженер П’єр Еміль Мартен винайшов спеціальну піч. Мартенівський процес став основним способом виробництва якісної рідкої сталі до сімдесятих років ХХ століття. Пізніше мартенівські печі поступилися місцем кисневим конверторам та електропечам.
Починаючи з 1866 року, Олександр Поль проводив детальне геологічне і геогностичне дослідження корисних копалин Криворізького регіону. Поль взяв в оренду багаті на залізну руду криворізькі землі з метою їх подальшого промислового використання. Саме завдяки йому наше місто стало металургійним гігантом.
Думаю, що розуміння будови атомів і складу різних хімічних елементів допоможуть вам, якщо ви оберете собі професію металурга.
Прошу вас об’єднатися в групи по кольорам. А яку ж теорію вам потрібно буде презентувати допоможе нам « Колесо фортуни»
( Групи отримують завдання)
https://wordwall.net/uk/resource/15122624/завдання-для-груп

А щоб наша робота була більш ефективною, скористуємось методикою „Світове кафе”.. Нагадаю вам правила:
• Господар організовує комунікацію, стимулює
вироблення
• Учасники схематизують ідеї та рішення на
ватмані
• Через 5 хв. учасники змінюють кафе
• Господар зустрічає нових учасників, коротко
інформує їх про прийняті рішення, організовує
дискусію для деталізації ідеї, домальовують
схеми
• Господарі кожного столика презентують
результати роботи свого кафе – по 2 хв.
• Підбиття підсумків – 2 хв.
( Матеріали роботи груп Додаток 2)
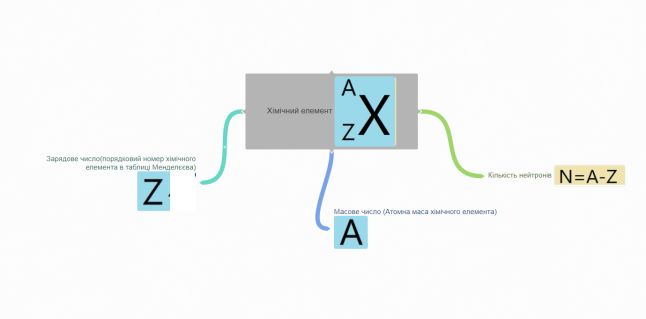
3.2. Склад атомного ядра..
Експерименти, здійснені вченими протягом ХІХ ст. довели, що атом має складну структуру. Результатом їх роботи стала ядерна модель будови атома – перший крок до сучасних уявлень про атом.
Будова ядра атома. (Пояснення ілюструється схемою)
- Ядро складається з позитивно заряджених частинок(протонів - р) і
нейтральних частинок (нейтронів - п). Протони і нейтрони, що входять до
складу ядра атома, називають нуклонами, ядра атомів узагальнено
називають нуклідами. Сумарну кількість протонів і нейтронів в атомі
називають нуклоним (або масовим) числом та позначають символом А.
- Кількість протонів у ядрі називають протонним (або зарядовим)
числом та позначають символом Z. Його легко визначити, скориставшись
“Періодичною системою хімічних елементів Д. І. Менделєєва”. Порядковий
номер хімічного елемента у періодичній таблиці відповідає кількості протонів у
ядрі (протонному числу).
- Знаючи протонне (Z) і нуклоне (А) числа ядра
атома хімічного елемента, можна визначити кількість
нейтронів (N) у ядрі атома цього елемента:
N = A - Z.
При позначенні ядра атома (нукліда) хімічного елемента перед символом
елемента вгорі вказується нуклоне число А, а внизу - протонне число Z.
https://coggle.it/diagram/YMDQ12Ck-HpVxqAQ/t/unnamed
Фізкультхвилинка
Рухівка «Австралійський дощ»
Піднявся вітер – потерти долоні.
Починає крапати дощ – клацати пальцями.
Починається справжня злива – плескати руками по стегнах.
Злива переходить у град – тупати ногами.
Буря стихає – плескати по стегнах.
Дощ стихає – поплескати по грудях однією рукою.
Рідкі краплі дощу падають на землю – клацати пальцями.
Тихий шелест вітру – потирати долоні.
З’являється сонце – піднімати руки вгору і посміхатися.
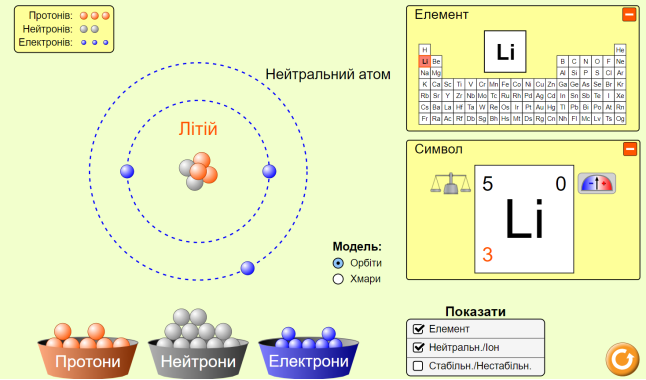
Давайте з вами навчимося знаходити склад атомів різних хімічних елементів. А допоможе нам в цьому фізичний симулятор PhET
https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_uk.html
4.Закріплення.
Що ви дізналися про атом? ( Метод « Мозковий штурм», результати відповідей записуємо у вигляді схеми в програмі coggle
https://coggle.it/diagram/YIUj_fg8T5TifMpt/t/-
Підсумок
Підіб’ємо підсумки.
- Чи зріс ваш рівень «науковця» ( Можна перенести свою наліпку на шкалі
« Трейлер»)
- Отже, на сьогоднішньому уроці ви дізналися про розвиток науки щодо вивчення атома, який протягом багатьох віків вважався найдрібнішою частинкою речовини.
Для того, щоб я могла дізнатися про ваші враження від уроку, прошу надіслати мені телеграму, а у відповідь ви отримаєте оцінку за роботу на уроці. ( Дошка padlet)
https://padlet.com/senkasok1975/j9srakizhs4xbnwh
6. Домашнє завдання.
- Вивчити п. 22
2. На початку уроку ви отримали певний хімічний елемент. Ваше завдання : знайти склад цього атома. ( Завдання рівня А)
3.* * Виконати тести. (Завдання рівня В)
https://kahoot.it/challenge/02178318?challenge-id=4a125a21-5c62-4950-a489-ab351a842f53_1623504531185


 4.Творче завдання: Створити лепбук з теми « Атом» або сконструювати модель атома.
4.Творче завдання: Створити лепбук з теми « Атом» або сконструювати модель атома.
Додаток 1
Додаток 2
І група: Модель атома Томсона
 Вчені не відразу прийшли до правильних уявлень про будову атома. Першу модель атома запропонував англійський фізик. Сер Джозеф Джон Томсон (18 грудня 1856 30 серпня 1940) англійський фізик, який відкрив електрон, лауреат Нобелівської премії по фізиці 1906 р. На думку Томсона, позитивний заряд атома займає весь об’єм атома й розподілений у цьому об’ємі зі сталою густиною. Найпростіший атом – атом водню – це позитивно заряджена куля радіусом близько 10-7см, у якій знаходиться електрон. У складніших атомів у позитивно зарядженій кулі є кілька електронів, так що атом подібний до кексу з родзинками, у якому родзинками є електрони.
Вчені не відразу прийшли до правильних уявлень про будову атома. Першу модель атома запропонував англійський фізик. Сер Джозеф Джон Томсон (18 грудня 1856 30 серпня 1940) англійський фізик, який відкрив електрон, лауреат Нобелівської премії по фізиці 1906 р. На думку Томсона, позитивний заряд атома займає весь об’єм атома й розподілений у цьому об’ємі зі сталою густиною. Найпростіший атом – атом водню – це позитивно заряджена куля радіусом близько 10-7см, у якій знаходиться електрон. У складніших атомів у позитивно зарядженій кулі є кілька електронів, так що атом подібний до кексу з родзинками, у якому родзинками є електрони.
Проте модель атома Томсона не узгоджувалась дослідами з вивчення розподілу позитивного заряду в атомі. Ці досліди, уперше поставлені англійським фізиком Е.Резерфордом, мали велике значення для розуміння будови атома.
ІІ група: Дослід Е. Резерфорда
Модифікуючи експериментальну установку, Е. Резерфорд спробував виявити відхилення α-частинок на великі кути. І цілком несподівано виявилося, що невелика кількість α-частинок (приблизно одна з двох тисяч) відхилялась на кути, більші від 90 градусів. Пізніше Резерфорд зізнався, що, запропонувавши своїм учням експеримент – спостереження розсіювання а-частинок на великі кути, сам не вірив у позитивний результат. «Це майже так само неймовірно, говорив Резерфорд, ніби ви вистрелили 15-дюймовим снарядом у клапоть тонкого паперу, а снаряд повернувся б до вас і вдарив вас».
І справді, передбачити цей результат було на основі моделі Томсона неможливо. Розподілений у всьому об’ємі атома позитивний заряд не може створити таке інтенсивне електричне поле, яке могло б відкинути а-частинку назад. Максимальна сила відштовхування визначається законом Кулона:
|q1||q2|
F = k —————.
r2
Де q заряд α-частинки, q позитивний заряд атома, R його радіус, F електрична сила. Напруженість електричного поля рівномірно зарядженої сфери максимальна на її поверхні й спадає до нуля з наближенням до центра сфери. Тому, чим менший радіус R, тим більша сила, що відштовхує α-частинки.
ІІІ група: Планетарна модель атома
З дослідів Резерфорда безпосередньо випливає планетарна модель атома. У центрі міститься позитивно заряджене ядро, у якому зосереджена майже вся маса. У цілому атом нейтральний, тому кількість внутрішньоатомних електронів дорівнює, як і заряд ядра, порядковому номеру елемента в періодичній системі. Зрозуміло, що електрони в атомі не можуть бути в стані спокою, бо вони впали б на ядро. Вони рухаються навколо ядра, подібно до того, як планети обертаються навколо Сонця. Цей рух відбувається під впливом кулонівської сили, з якою діє ядро.
В атомі водню навколо ядра обертається лише один електрон. Ядро атома водню має позитивний заряд, який за модулем дорівнює заряду електрона, і масу, приблизно в 1836,1 рази більшу від маси електрона. Це ядро дістало назву протона, і його почали розглядати як елементарну частину. Розмір атома – це радіус орбіти його електрона.
Проста й наочна планетарна модель атома має пряме експериментальне обґрунтування. Вона конче потрібна для пояснення дослідів на розсіювання α-частинок. Але ця модель зовсім не може пояснити сам факт існування атома, його стійкість. Адже електрони рухаються по орбітах з прискоренням, і не малим. Заряд, який рухається з прискоренням, за законами електродинаміки Максвела має випромінювати електромагнітні хвилі з частотою, що дорівнює частоті його обертання навколо ядра. Випромінювання супроводжується втратою енергії. Втрачаючи енергію, електрони мають наближатися до ядра, подібно до того, як супутник наближається до Землі внаслідок гальмування у верхніх шарах атмосфери. Як показують точні розрахунки, що ґрунтуються на механіці Ньютона й електродинаміці Максвела, електрон за інтервал часу порядку 10-8 секунди має впасти на ядро. Атом має припинити своє існування.
Насправді нічого подібного не відбувається. Атоми стійкі і в не збудженому стані можуть існувати необмежено довго, зовсім не випромінюючи електромагнітних хвиль.
Висновок про неминучу загибель атома внаслідок втрати енергії на випромінювання не узгоджувався з дослідом і був результатом застосування законів класичної фізики до явищ, які відбуваються в атомі. Звідси виходить, що до явищ атомних масштабів закони класичної фізики незастосовні.
Резерфорд створив планетарну модель атома: електрони обертаються навколо ядра подібно до того, як планети обертаються навколо Сонця. Ця модель проста, обґрунтована експериментально, але не пояснює стійкості атома.
Чому цей урок можна вважати інноваційним?
Даний урок надає можливість учням здобути необхідні навички та задовольнити їхні освітні потреби завдяки STEM підходу. Урок є інтегрований, об’єднує використання набутих знань з хімії та інформатики.
Кожна діяльність чітко зрозуміла учням: групова робота( метод « Світове кафе»), робота з програмними засобами (mentimeter, wordwall , coggle, phet.colorado, padlet, kahoot) , творче розв’язання задач ( створення лепбуку, моделей атомів), самостійна робота ( опрацювання нового матеріалу методом « Випереджальне домашнє завдання) діти безпосередньо залучені до структури заняття.
Сучасні випускники – майбутні новатори та інноватори – мають отримувати ґрунтовні знання з природничих і технічних наук у поєднанні з навичками 21-го століття, таких як уміння спілкуватися, працювати в команді та вирішувати проблеми в контексті інноваційних можливостей та поточних потреб суспільства. Саме такий підхід до викладання обраної теми робить його інноваційним і дозволяє реалізувати поставлені освітні задачі.
Чим даний урок відрізняється від уроків, які ви проводили в школі раніше?
Класичний підхід до викладання фізики вже не задовольняє потреби суспільства,. STEM підхід, використаний у моєму уроці, може не лише допомогти вчасно розкрити таланти і здібності юних новаторів, але і дати можливість наблизитися до природничих наук і перестати боятися «складних матерій». Мій урок створений разом з учнями. Вивчення цієї теми діти здійснюють активно, залучені до активної діяльності.
Навчання – це не просто передача знань від учителя до учнів, це спосіб розширення свідомості і зміни реальності. Саме тому розроблений урок у STEM-освіті дасть можливість зробити кар’єру в інженерно-технічній сфері. Діти отримують можливість не просто вивчати певні закони, а одразу випробовувати їхню дію на практиці, створюючи справжні наукові проекти.
На жаль, зазвичай уроки не викликають інтересу, – реалії більшості нинішніх шкіл. Вони переважно нудні для дітей. Адже протягом занять учні вивчають теоретичні відомості, численні формули, але практично не мають уявлення, як це насправді працює, і де всі ці знання можна використати у повсякденному житті. Уроки фактично позбавлені практичних занять, творчості та будь-яких експериментів. Наука повинна захоплювати!
Урок з STEM-підходом є значно ефективнішим в організації освітнього процесу: навчання шляхом моделювання, проектування та експериментування перетворюється на своєрідну гру, тому сприймається школярами із величезним задоволенням.
Реалізувати такий урок допомогли мені знання отримані у програмі STEAM CAMP.
Залишилося тільки дочекатися, щоб наші школи були достатньо забезпечені інтернетом, комп’ютерами для того щоб ми могли працювати в реаліях сучасного життя.
Які методики та підходи були використані під час його підготовки?
Під час підготовки уроку особливу увагу приділила використанню в навчальному процесі технічних засобів і програмного навчання; словесні, наочні та практичні методи; проблемно-пошуковий метод.
Методи стимулювання інтересу, інтегроване навчання, розвиток критичного мислення , інноваційність робота в команді, профорієнтація.
Інтерактивні методи:
1. Метод « Трейлер»
2. Вправа « Асоціативний кущ»
3. Методика « Світове кафе» (групова форма роботи)
4. Різнорівневе домашнє завдання.
5. Випереджальне домашнє завдання.
Діджитал інструменти: mentimeter, wordwall , coggle, phet.colorado, padlet, kahoot

про публікацію авторської розробки
Додати розробку
